Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Методы иммунохимического анализа
Анализ белков методами диффузии в геле
Количественные методы иммунодиффузии
Попытки разработать методы иммунодиффузии, позволяющие количественно оценивать содержание антигенов и антител, делались неоднократно. Одна группа таких методов основывается на двойной диффузии в геле по Ухтерлони (см. стр. 131), другая — на измерении скорости диффузии и степени мутности полос преципитации при иммуноэлектрофорезе (стр. 137). Пока эти методы еще не получили широкого распространения.
МЕТОД ГРАДИЕНТА КОНЦЕНТРАЦИИ АНТИТЕЛ ПО ФЕЙНБЕРГУ [6]
Принцип метода. В результате диффузии антигена в пластинке агарового геля, содержащего иммунную сыворотку, образуется преципитат. Наибольшее разведение антигена, при котором еще происходит преципитация, является его титром.
Область применения. Титрование раствора антигена.
МЕТОДИКА
1. Приготовление пластинки агарового геля. 1%-ный расплавленный агар наливают на дно чашки Петри (см. стр. 131). В затвердевшем агаровом геле при помощи пробойника для пробок или иного подходящего для этой цели инструмента (фиг. 34) делают лунки для исследуемого антигена и антисыворотки, как описано на стр. 131. Центральная лунка в диаметре должна примерно в 4 раза превышать расположенные на равном расстоянии от нее периферические лунки (12-16 и 3-4 мм соответственно). Две соседние периферические лунки должны отстоять друг от друга дальше, чем от центральной лунки.
2. Титрование антигена. В центральную лунку заливают 0,2 мл иммунной сыворотки, агаровую пластинку помещают во влажную камеру и оставляют при 37°С на 24—72 ч. В результате диффузии иммунной сыворотки от центральной лунки по направлению к периферическим возникает градиент концентрации антител.
По истечении времени, достаточного для образования градиента концентрации антител, в периферические лунки заливают заранее приготовленные препараты исследуемого антигена в соответствующем разведении. В каждую лунку с помощью микропипетки или капиллярной пипетки, имеющей метку, вносят строго один и тот же объем раствора.
Через 24 ч повторной инкубации во влажной камере при 37°С в агаровом геле вокруг периферических лунок образуются полосы (или кольца) преципитации. Регистрируя их, определяют наибольшее разведение антигена, при котором еще наблюдается реакция преципитации, и принимают его за титр исследуемого антигена.
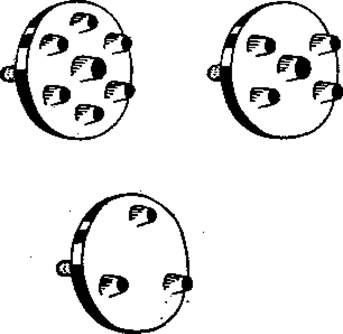
Фиг. 34. Штампы для вырезания лунок в агаровом геле.
ПРИМЕЧАНИЯ
Существует другой, менее чувствительный метод титрования антигена или антител, также разработанный Фейнбергом и заключающийся в следующем.
Специфическую иммунную сыворотку при титровании антигена или раствор известного антигена при титровании антисыворотки смешивают с расплавленным агаром и выливают на дно чашки Петри.
После затвердения агара в геле вырезают лунки и заполняют их раствором антигена или антисыворотки. Диффундируя в геле, антиген или антитела встречаются с соответствующим специфическим партнером, что приводит к весьма быстрому появлению колец преципитации вокруг лунок. Реакцию можно учитывать уже через 30 мин, но окончательную оценку следует проводить через 24 ч инкубации при 37°С во влажной камере. Ошибка этого метода количественного определения антигенов й антител составляет ±25%. Точность метода повышается, если ставить много параллельных проб.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКОВОГО АНТИГЕНА В СЛОЕ АГАРОВОГО ГЕЛЯ, СОДЕРЖАЩЕГО СПЕЦИФИЧЕСКИЕ АНТИТЕЛА [5]
Принцип метода. Исследуемый белковый антиген, диффундируя из лунки, образует в агаровом геле, содержащем моноспецифические антитела, преципитат в виде кольца, диаметр которого пропорционален концентрации этого антигена.
Область применения. Количественное определение белков, определение концентрации индивидуальных компонентов белковой смеси (например, сыворотки крови).
МЕТОДИКА
1. Приготовление агаровой пластинки, содержащей антитела. Готовят 3%-ный агар на 0,03 М калий-фосфатном буферном растворе pH 8,0, содержащем 0,1 М NaCl, и помещают его в водяную баню при 56°С. Соответствующую моноспецифическую антисыворотку разбавляют в зависимости от титра фосфатным буферным раствором (см. примечание 2) и нагревают также до 56°С. 8 мл нагретого 3%-ного агара и 8 мл подогретой антисыворотки смешивают при 56°С и 15 мл смеси наливают на стеклянную пластинку размером 8 х 10 см, расположенную на горизонтальной поверхности. После затвердения агара пластинку помещают во влажную камеру и хранят в холодильнике до использования. (Рекомендуется к смеси агара и антисыворотки добавлять мертиолат в разведении 1 : 10 000.)
2. Приготовление лунок для исследуемого антигена. При помощи подходящего инструмента (см. стр. 131) в агаровом геле вырезают лунки для антигена диаметром 2,4 мм, расположенные на расстоянии 12 мм друг от друга. Обычно на углах пластинки поверхность агара получается недостаточно ровной и образующиеся кольца преципитации не имеют правильных очертаний, поэтому четыре угловых лунки оставляют пустыми.
3. Заполнение лунок. Часть лунок в агаровом геле заполняют капиллярной пипеткой заранее приготовленными растворами белка известной концентрации в соответствующих разведениях. В оставшиеся лунки наливают исследуемые образцы белковых смесей, например сыворотки крови. Следует тщательно следить за тем, чтобы во всех лунках был налит одинаковый объем растворов, заполняющий их точно до краев. После этого агаровую пластинку помещают во влажную камеру и на 24 ч оставляют в холодильнике.
4. Оценка результатов. В агаровом геле, содержащем моноспецифические антитела и диффундирующий антиген, образуются кольца преципитации. Диаметр такого кольца проще всего измерить, рассматривая его на темном фоне с подсветкой под определенным углом. Сначала измеряют диаметры преципитационных колец вокруг лунок с разведенными стандартными растворами белка и строят график зависимости этих величин (в мм) от логарифма концентрации раствора. Измерив диаметры преципитационных колец вокруг лунок исследуемых образцов, с помощью полученной калибровочной кривой определяют концентрации анализируемого белка.
ПРИМЕЧАНИЯ
1. Для успешного осуществления этого метода основное значение имеют два момента. Во первых, наличие иммунохимически чистого (т. е. не содержащего других белковых фракций) препарата того белка, концентрацию которого требуется определить в смеси. Этот белок используется в реакции в виде стандартного раствора известной концентрации. Во-вторых, необходимо располагать моноспецифической (т. е. реагирующей только с данным белком) иммунной сывороткой.
2. Титры антител в иммунных сыворотках могут широко варьировать. Поэтому в предварительных опытах следует определить то разведение антисыворотки, при котором наблюдаются наиболее четкие и легко регистрируемые преципитационные кольца. В зависимости от титра имеющейся в распоряжении исследователя антисыворотки ее можно использовать в 8-, 16- или 32-кратном разведении.
3. При учете результатов реакции через 24 ч между концентрацией антигена и диаметром преципитационного кольца выявляется логарифмическая зависимость. Однако можно производить учет реакции и через больший отрезок времени, продолжая наблюдать за диффузией антигена в геле и ежедневно измеряя диаметры преципитационных колец. Через несколько дней в наблюдаемой системе наступает равновесие, т. е. избыток антигена в лунке исчезает и увеличение диаметра преципитационного кольца прекращается. На этой стадии существует линейная зависимость между концентрацией антигена и диаметром преципитационного кольца.
4. Данный метод хорошо. себя зарекомендовал при определении содержания тех фракций сыворотки крови, которые удается выделить в достаточно чистом виде (например, IgG, IgA, IgM, трансферрин. и альбумин). Вообще с помощью этого метода можно определить концентрацию любого гомогенного белка, если располагать специфичной к нему антисывороткой.
5. Результаты реакции можно зарегистрировать, фотографируя нативный препарат или окрашивая его красителями, выявляющими белок (см. стр. 135). Окрашивание в ряде случаев облегчает регистрацию результатов, так как окрашенные преципитационные кольца легче измерять. Однако оно может и затруднить измерение, если при этом, например, изменяется форма кольца.
КОЛИЧЕСТВЕННЫЙ ИММУНОЭЛЕКТРОФОРЕЗ ПО БАКХАУЗУ? [1]
Сначала исследуемый антиген подвергают электрофорезу макрометодом, описанным на стр. 137. Затем в непосредственной близости от области разделения антигена агаровом геле вырезают широкий желобок, который заполняют смесью расплавленного агара с иммунной сывороткой. Белки, разделенные в электрическом поле, диффундируют в агаровый гель, содержащий антитела. Расстояние, проходимое белками обусловлено закономерностями линейной диффузии в геле (см. стр. 128). Поэтому, измерив смещение вершин преципитационных полос от границы желобка, можно определить скорость диффузии, т. е. величину k, а с ее помощью и концентрацию исследуемых белковых фракций.