Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ концевых групп и ступенчатая деградация белков и пептидов
Определение N-концевых групп 2,4-динитрофторбензольным методом
Хроматография ДНФ-аминокислот на бумаге
ДНФ-аминокислоты идентифицируют с помощью одно- или двумерной хроматографии на бумаге и определяют их количество соответствующими методами [11].
МЕТОДИКА
А. Метод Леви с использованием толуола. Очистка толуола. Перегнанный толуол 24 ч перемешивают с серной кислотой (1 : 1). Органическую фазу декантируют и отгоняют над АlСl3. Перегнанный толуол встряхивают несколько раз с 20%-ным раствором Na2CО3 для удаления кислоты, затем обезвоживают с СаСl2 и повторно перегоняют.
Подготовка стеклянной камеры для хроматографии на бумаге. Хроматографию проводят в темноте при постоянной температуре в стеклянном цилиндре высотой 46 см и диаметром 23 см, на дно которого помещают один в другой два кристаллизатора диаметром 15 и 19 см.
Размер листа фильтровальной бумаги. Размер и форма листа фильтровальной бумаги, так же как и место нанесения образца при двумерной хроматографии на бумаге, показаны на фиг. 57.
Приготовление фосфатного буферного раствора. Для хроматографии необходим 1,5 М фосфатный буферный раствор pH 6, который готовят следующим образом: 138 г NaH2PО4 ∙ Н2О и 71 г Na2HPО4 растворяют в теплой воде и доводят объем до 1 л.
Приготовление толуольной системы. 60 мл толуола, 18 мл пиридина, 36 мл этиленхлоргидрина и 36 мл 0,8 М аммиака тщательно взбалтывают в делительной воронке и оставляют на несколько часов. Нижнюю водную фазу отбрасывают, а органическую фазу фильтруют через бумагу для удаления капель воды.
Хроматография. После нанесения образца бумагу сворачивают в цилиндр и помещают между двумя кристаллизаторами в органическую фазу смеси растворителей через 6 ч после того, как органическая фаза была налита во внешнее пространство, а 200 мл 0,8 М аммиака — во внутреннее. Восходящая хроматография длится 15 ч, после чего хроматограмму высушивают при 40—50° С. Затем проводят нисходящую хроматографию в другом направлении в уже упомянутом фосфатном буферном растворе.
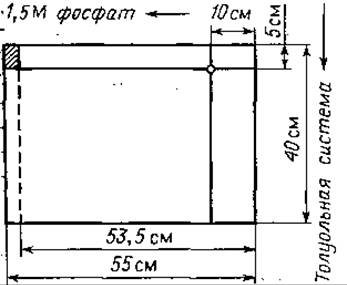
Фиг. 57. Размеры листа фильтровальной бумаги для хроматографии ДНФ-аминокислот [11].
Распределение ДНФ-аминокислот при двумерной хроматографии показано на фиг. 58. При анализе сложных смесей неизвестного состава идентификацию проводят с помощью одновременно приготовленных одномерных контрольных хроматограмм.
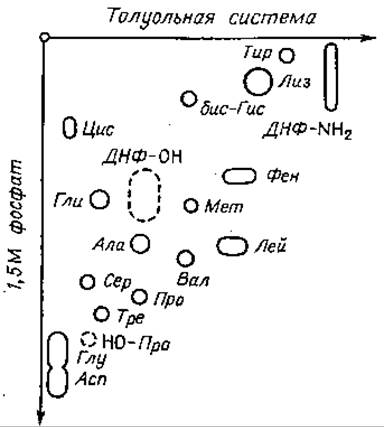
Фиг. 58. Двумерная хроматография ДНФ-аминокислот [11].
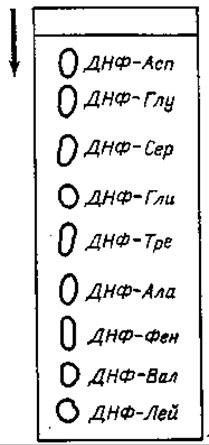
Фиг. 59. Хроматография ДНФ аминокислот в цитратном буферном растворе.
Б. Цитратный метод Ровера [15]. Большая часть ДНФ-аминокислот может быть разделена в 1 М цитратном буферном растворе pH 6,4 (фиг. 59). Метод особенно удобен для количественных определений в случае не очень сложных смесей, например смеси нескольких ДНФ-аминокислот и ДНФ.
В. Система третичный амиловый спирт — фталат [1].
1) Приготовление фталатного буферного раствора. 22,45 г бифталата калия суспендируют в 220 мл воды, который растворяется в этом объеме при добавлении 4 г NaOH, перемешивании и слабом нагревании. Если это необходимо, раствор фильтруют и затем разводят в 10 раз водой. Проверяют pH раствора и, если он не равен 6,0, доводят его до этого значения разбавленными растворами NaOH или уксусной кислоты. Отклонения pH на 0,1—0,2 единицы не существенны для хроматографии.
При использовании фталатного буферного раствора pH 5 разделение ДНФ-аминокислот значительно отличается от фракционирования в буферном растворе pH 6. При pH 5 хорошо разделяются ДНФ-Асп и ДНФ-Глу, тогда как в других условиях они движутся вместе.
Приготовление фталатного буферного раствора pH 5. 50 мл 0,1 М раствора бифталата калия смешивают с 23,9 мл 0,1 н. NaOH и смесь разводят до 100 мл дистиллированной водой.
2) Приготовление смеси растворителей. В делительную воронку на 1 л наливают 300 мл третичного амилового спирта и 300 мл фталатного буфера. Смесь тщательно встряхивают и оставляют отстаиваться несколько часов. Затем фазы отделяют друг от друга, органическую фазу фильтруют через бумагу и наливают в хроматографическую камеру.
3) Приготовление фильтровальной бумаги. Фильтровальную бумагу предварительно увлажняют фталатным буферным раствором и высушивают несколько дней на воздухе. Наилучшие результаты получают на бумаге Шляйхер-Шуль 2043 b.
Разделение ДНФ-аминокислот в системе третичный амиловый спирт—фталат показано на фиг. 60.
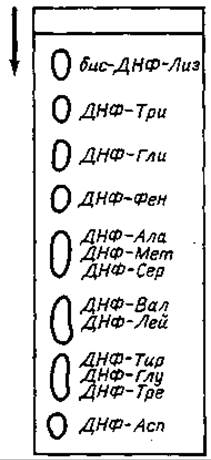
Фиг. 60. Хроматография ДНФ-аминокислот в системе третичный амиловый спирт—фталат.