БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 1. СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
II. Структура белков
Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединённых прочными пептидными связями. За счёт внутримолекулярных взаимодействий белки образуют определённую пространственную структуру, называемую «конформация белков». Линейная последовательность аминокислот в белке содержит информацию о построении трёхмерной пространственной структуры. Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами (рис. 1-3). Существуют общие правила, по которым идёт формирование пространственных структур белков.
Рис. 1-3. Этапы формирования конформации белков. 1 — первичная структура; 2 — вторичная структура; 3 — третичная структура; 4 — четвертичная структура.

А. Первичная структура
Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке. Линейную последовательность аминокислотных остатков в полипептидной цепи называют «первичная структура белка».
Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка (см. раздел 4).
Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого.
Б. Методы изучения первичной структуры белка
Изучение первичной структуры белков имеет важное общебиологическое и медицинское значение. Изучая порядок чередования аминокислотных остатков в индивидуальных белках и сопоставляя эти знания с особенностями пространственного расположения молекулы, можно выявить общие фундаментальные закономерности формирования пространственной структуры белков.
Кроме того, многие генетические болезни — результат нарушения в аминокислотной последовательности белков. Информация о первичной структуре нормального и мутантного белка может быть полезна для диагностики и прогнозирования развития заболевания.
Установление первичной структуры белков включает 2 основных этапа:
✵ определение аминокислотного состава изучаемого белка;
✵ определение аминокислотной последовательности в белке.
1. Определение аминокислотного состава белка
Первый этап в определении первичной структуры белков заключается в качественной и количественной оценке аминокислотного состава данного индивидуального белка. Необходимо помнить, что для исследования нужно иметь определённое количество чистого белка, без примесей других белков или пептидов.
Кислотный гидролиз белка
Для определения аминокислотного состава необходимо провести разрушение всех пептидных связей в белке. Анализируемый белок гидролизуют в 6 мол/л НСl при температуре около 110 °С в течение 24 ч. В результате такой обработки разрушаются пептидные связи в белке, а в гидролизате присутствуют только свободные аминокислоты. Кроме того, глутамин и аспарагин гидролизуются до глутаминовой и аспарагиновой кислот (т. е. разрывается амидная связь в радикале и от них отщепляется аминогруппа).
Разделение аминокислот с помощью ионообменной хроматографии
Смесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с катионообменной смолой. Такая синтетическая смола содержит прочно связанные с ней отрицательно заряженные группы (например, остатки сульфоновой кислоты -SO3-), к которым присоединены ионы Na+(рис. 1-4).
Рис. 1-4. Разделение аминокислот с помощью ионообменной хроматографии. А. Хроматографическая колонка, наполненная катионообменной смолой. Б. Этапы разделения аминокислот: 1 — присоединение аминокислот к частицам смолы; 2 — высвобождение аминокислот при определённом значении pH и концентрации NаСl.

В катионообменник вносят смесь аминокислот в кислой среде (pH 3,0), где аминокислоты в основном представляют катионы, т. е. несут положительный заряд. Положительно заряженные аминокислоты присоединяются к отрицательно заряженным частицам смолы. Чем больше суммарный заряд аминокислоты, тем прочнее её связь со смолой. Так, аминокислоты лизин, аргинин и гистидин наиболее прочно связываются с катионообменником, а аспарагиновая и глутаминовая кислоты — наиболее слабо.
Высвобождение аминокислот из колонки осуществляют вымыванием (элюированием) их буферным раствором с увеличивающейся ионной силой (т. е. с увеличением концентрации NaCl) и pH. При увеличении pH аминокислоты теряют протон, в результате уменьшается их положительный заряд, а, следовательно, и прочность связи с отрицательно заряженными частицами смолы.
Каждая аминокислота выходит из колонки при определённом значении pH и ионной силы. Собирая с нижнего конца колонки раствор (элюат) в виде небольших порций, можно получить фракции, содержащие отдельные аминокислоты.
Количественный анализ полученных фракций
Количество каждой из аминокислот в данном белке определяют, нагревая отдельные фракции аминокислот с нингидрином, образующим соединение красно-фиолетового цвета. Интенсивность окраски в пробе пропорциональна количеству находящейся в ней аминокислоты, поэтому по спектрофотометрическому измерению света, поглощённого нингидриновыми производными, можно определить содержание каждой аминокислоты в гидролизате данного белка.
В настоящее время процесс разделения и количественного определения аминокислот в гидролизате белка полностью автоматизирован и осуществляется в специальном приборе — аминокислотном анализаторе.
2. Определение аминокислотной последовательности в белке
Определение N-концевой аминокислоты в белке и последовательности аминокислот в олигопептидах
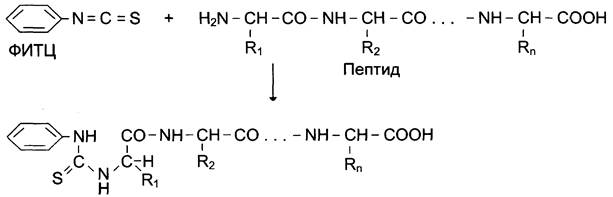
Фенилизотиоционат (ФИТЦ) — реагент, используемый для определения 14-концевой аминокислоты в пептиде. Он способен реагировать с α-аминогруппой и α-карбоксильной группой свободных аминокислот, а также с N-концевой аминокислотой в пептидах (см. схему ниже).
В результате взаимодействия с N-концевой аминокислотой полипептида образуется фенил- тиогидантионовое производное, в котором дестабилизирована пептидная связь между α-карбоксильной группой N-концевой аминокислоты и α-аминогруппой второй аминокислоты в пептиде. Эта связь избирательно гидролизуется без повреждения других пептидных связей.

После реакции выделяют комплекс ФИТЦ- АК1, идентифицируют его хроматографическими методами. ФИТЦ можно использовать вновь с укороченным пептидом, полученным в предыдущем цикле, для определения следующей аминокислоты. Этот процесс ступенчатого расщепления пептида с N-конца был автоматизирован и реализован в приборе — секвенаторе, с помощью которого можно определять последовательность аминокислотных остатков в олигопептидах, состоящих из 10 — 20 аминокислот.
Многие полипептиды имеют первичную структуру, состоящую более чем из 100 аминокислот. Так как с помощью секвенаторов наиболее продуктивно определяют аминокислотную последовательность лишь небольших пептидов, молекулы полипептида расщепляют по специфическим местам на фрагменты.
Используя несколько разных расщепляющих агентов (ими могут быть ферменты или химические вещества) в разных пробах очищенного полипептида, можно получить частично перекрывающие друг друга фрагменты с установленной аминокислотной последовательностью. С их помощью можно воссоздать правильный порядок фрагментов и получить полную последовательность аминокислот в полипептидной цепи.
Ферментативное расщепление полипептида по специфическим участкам
Для специфического расщепления пептидных связей в белке можно использовать несколько разных ферментов. Наиболее широко используют ферментативный гидролиз полипептида протеолитическим ферментом — трипсином, который относят к группе пищеварительных ферментов (его вырабатывает поджелудочная железа). Фермент обладает высокой специфичностью действия. Он расщепляет пептидные связи, в образовании которых участвует карбоксильная группа остатков лизина или аргинина.

Исходя из установленного количества остатков лизина и аргинина, можно предсказать количество получаемых при гидролизе трипсином фрагментов. Так, если в полипептидной цепи 6 остатков аргинина и лизина, то при расщеплении трипсином можно получить 7 фрагментов.
Схема
Затем в каждом фрагменте устанавливают аминокислотную последовательность.
Химическое расщепление полипептида по специфическим участкам
В некоторых случаях предпочтителен не ферментативный, а химический гидролиз. Так, реагент бромциан расщепляет только пептидные связи, в которых карбоксильная группа принадлежит остатку метионина. Зная количество остатков метионина в полипептидной цепи, легко установить количество получаемых фрагментов. Далее для каждого фрагмента в секвенаторе также устанавливают аминокислотную последовательность.
Получение аминокислотной последовательности полипептида с помощью перекрывающихся фрагментов
Для успешного установления последовательности полученных фрагментов полипептида необходимо получить пептиды с перекрывающимися аминокислотными последовательностями. Это достигают обработкой отдельных проб данного полипептида разными реагентами, расщепляющими белок в разных местах. Необходимо провести столько расщеплений, чтобы получить набор пептидов, обеспечивающих перекрывание всех участков, необходимых для определения последовательности исходного полипептида.
Установление первичной структуры белка с помощью перекрывающихся пептидных фрагментов.

В. Конформация белков
Линейные полипептидные цепи индивидуальных белков за счёт взаимодействия функциональных групп аминокислот приобретают определённую пространственную трёхмерную структуру, называемую «конформация». Все молекулы индивидуальных белков (т. е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию. Следовательно, вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков.
В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
1. Вторичная структура белков
Вторичная структура белков — пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спираль и β-структура.
α-Спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1-5). На один виток α-спирали приходится 3,6 аминокислотных остатка.
Рис. 1-5. α-Спираль. На рисунке показаны пространственное строение α-спирализованного участка полипептидной цепи и образование водородных связей, участвующих в формировании α-спирали.

В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате α-спираль «стягивается» множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность α-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т. е. способность образовывать водородные связи с водой) α-спиралей уменьшается, а их гидрофобность увеличивается.
α-Спиральная структура — наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования α-спиралей полипептидная цепь укорачивается, но, если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
Радикалы аминокислот находятся на наружной стороне α-спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерных для вторичной структуры, но некоторые из них могут нарушать формирование α-спирали. К ним относят:
✵ пролин. Его атом азота входит в состав жёсткого кольца, что исключает возможность вращения вокруг -N-СН- связи. Кроме того, у атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
✵ участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
✵ участки с близко расположенными объёмными радикалами, механически нарушающими формирование α-спирали, например, метионин, триптофан.
β-Структура
β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями. β-Структура образует фигуру, подобную листу, сложенному «гармошкой», — β-складчатый слой (рис. 1-6).
Рис. 1-6. Вторичная структура белков в виде β-складчатого слоя.

Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В β-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная β-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного β-складчатого слоя (рис. 1-7).
Рис. 1-7. Параллельный и антипараллельный β-складчатые слои. β-Структуры обозначены широкими стрелками. А - антипараллельная β-структура; Б - параллельные β-складчатые структуры.

В отличие от α-спиралей, разрыв водородных связей, формирующих β-структуры, не вызывает удлинения данных участков полипептидных цепей.
Как α-спираль, так и β-структуры обнаружены в глобулярных и фибриллярных белках.
Нерегулярные вторичные структуры
В белках отмечают области с нерегулярной вторичной структурой, которые часто называют беспорядочными клубками. Они представлены петлеобразными и кольцеобразными структурами, имеющими меньшую регулярность укладки, чем описанные выше α-спираль и β-струкгура. Однако и они не так сильно варьируют от одной молекулы белка к другой. В каждом индивидуальном белке они имеют свою фиксированную конформацию, определяемую аминокислотным составом данного участка цепи и окружающих его участков.
Термином «беспорядочный клубок» также часто называют денатурированный белок, образовавшийся после разрыва слабых внутримолекулярных связей и потерявший свою упорядоченную структуру.
Содержание разных типов вторичных структур в белках
Содержание рассмотренных выше типов вторичных структур в разных белках неодинаково. По наличию α-спиралей и β-структур глобулярные белки можно разделить на 4 категории.
✵ К первой категории относят белки, в структуре которых обнаружены только α-спирали. К ним принадлежат такие белки, как миоглобин и гемоглобин (рис. 1-8).
Рис. 1-8. Восемь α-спиралей в структуре миоглобина (А) и β-цепи гемоглобина (Б).

✵ Ко второй категории относят белки с α-спиралями и β-структурами, иногда образующими однотипные сочетания, встречающиеся в разных индивидуальных белках (рис. 1-9). Характерные сочетания α-спиралей и β- структур, обнаруженные во многих ферментах, можно рассмотреть на примере строения доменов лактатдегидрогеназы (ЛДГ) и фосфоглицераткиназы (ФГК). Домен — участок полипептидной цепи, который самостоятельно от других участков той же цепи образует структуру, во многом напоминающую глобулярный белок.
Рис. 1-9. α-Спирали и β-структуры в домене лактатдегидрогеназы (А) и фосфоглицераткиназы (Б).

В одном из доменов лактатдегидрогеназы в центре расположены β-структуры полипептидной цепи в виде скрученного листа, и каждая β-структура связана с α-спиральным участком, находящимся на поверхности молекулы. Как видно из рис. 1-9, сходный домен имеется также в молекуле фосфоглицераткиназы.
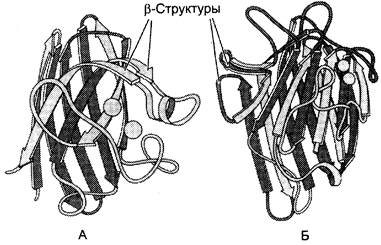
✵ В третью категорию включены белки, имеющие только β-структуры. Такие структуры обнаружены в иммуноглобулинах, в ферменте супероксиддисмутазе (рис. 1-10).
Рис. 1-10. β-Складчатая вторичная структура в константном домене иммуноглобулина (А) и ферменте супероксиддисмутазе (Б).
✵ В четвёртую категорию включены белки, имеющие в своём составе лишь незначительное количество регулярных вторичных структур.
2. Третичная структура белков
Третичная структура белков — трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи, участвующие в формировании третичной структуры белков
Гидрофобные взаимодействия
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро.Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
Ионные и водородные связи
Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей (рис. 1-11).
Рис. 1-11. Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка. 1 — ионные связи; 2 — водородные связи; 3 — гидрофобные связи; 4 — дисульфидные связи.

Ионные связи могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина.
Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -СОNН2, SН-группы) и любыми другими гидрофильными группами.
Белки, функционирующие в неполярном (липидном) окружении, например, белки мембран, имеют обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В каждом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение.
Ковалентные связи
Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SН-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов (рис. 1-12).
Рис. 1-12. Образование дисульфидной связи в белках.

Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи распространены в белках, секретируемых клеткой во внеклеточное пространство. Полагают, что эти ковалентные связи стабилизируют конформацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины.
Инсулин — белковый гормон; содержит 51 аминокислоту, состоит из двух полипептидных цепей (цепь А содержит 21 аминокислоту, цепь В — 30 аминокислот). Инсулин синтезируется в β-клетках поджелудочной железы и секретируется в кровь в ответ на повышение концентрации глюкозы в крови. В структуре инсулина имеются 2 дисульфидные связи, соединяющие 2 полипептидные цепи А и В, и 1 дисульфидная связь внутри цепи А (рис. 1-13). Структура иммуноглобулинов рассмотрена в подразделе 6 Д.
Рис. 1-13. Дисульфидные связи в структуре гормона инсулина.

Все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для данного индивидуального белка конформацию, определяющую его специфическую функцию. Функционально активную конформацию белка называют «нативная структура».
3. Конформационная лабильность белков
Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых, так как их энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т. е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи.
Однако белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью — склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют огромную роль в функционировании белков в живой клетке.
4. Денатурация белков
Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её нативной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т. е. первичная структура белка не нарушается.
В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка.
Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами (рис. 1-14). Термическая обработка мясной пищи перед употреблением не только улучшает ее вкусовые качества, но и облегчает её ферментативное переваривание в пищеварительной системе. Кроме того, денатурирующим действием на пищевые белки обладает и кислая среда желудка, вызывающая денатурацию тех белков, которые не подвергались предварительной температурной обработке, а также оказывает денатурирующее действие на белки микроорганизмов, попавших в желудок с пищей.
Рис. 1-14. Структура нативной молекулы белка (в центре) и трёх денатурированных молекул этого же белка.

5. Факторы, вызывающие денатурацию белков
Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
✵ высокая температура (более 50 °С), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей;
✵ интенсивное встряхивание раствора, приводящее к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул;
✵ органические вещества (например, этиловый спирт, фенол и его производные) способны взаимодействовать с функциональными группами белков, что приводит к их конформационным изменениям. Для денатурации белков в биохимических исследованиях часто используют мочевину или гуанидинхлорид, которые образуют водородные связи с амино- и карбонильными группами пептидного остова и некоторыми функциональными группами радикалов аминокислот. Происходит разрыв связей, участвующих в формировании вторичной и третичной структуры нативных белков, и образование новых связей с химическими реагентами;

✵ кислоты и щелочи, изменяя pH среды, вызывают перераспределение связей в молекуле белка;
✵ соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.) образуют прочные связи с важными функциональными группами белков (чаще всего с -SН), изменяя их конформацию и активность;
✵ детергенты — вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными). Гидрофобные радикалы белков взаимодействуют с гидрофобными частями детергентов, что изменяет конформацию белков. Денатурированный под действием детергентов белок обычно остаётся в растворённом виде, так как гидрофильные части денатурирующего вещества удерживают его в растворе. К наиболее известным детергентам относят различные мыла (рис. 1-15).
Рис. 1-15. Денатурация белков с помощью детергентов.

6. Медицинские аспекты конформационной лабильности белков
Склонность большинства белков к денатурации в процессе их выделения, хранения и использования серьёзно затрудняет их получение и применение в медицине.
Для правильного обращения с белковыми лекарственными препаратами к ним прикладывают инструкцию, в которой указывают условия их хранения и использования. Так, большинство белковых препаратов необходимо хранить в холодильнике при температуре не выше 10 °С, растворять сухие препараты охлаждённой до комнатной температуры кипячёной водой во избежание их денатурации.
7. Применение денатурирующих агентов в биологических исследованиях и медицине
В биохимических исследованиях перед определением в биологическом материале низкомолекулярных соединений из раствора обычно удаляют белки. Для этой цели чаще всего используют трихлоруксусную кислоту. После её добавления в раствор денатурированные белки выпадают в осадок и легко удаляются фильтрованием. Трихлоруксусную кислоту можно также использовать для денатурации ферментов в целях прекращения ферментативной реакции.
В медицине денатурирующие агенты часто используют для стерилизации медицинских инструментов и материала, а также в качестве антисептиков. Например, в автоклавах при высокой температуре стерилизуют медицинские инструменты и материалы.
Фенол и его производные (крезол, резорцин) относят к известным антисептикам ароматического ряда. Обладающие высокой гидрофобностью, они эффективно действуют на вегетативные формы бактерий и грибы, вызывая денатурацию их белков. Эффективность антисептических свойств уменьшается с увеличением растворимости препарата в воде.

Раствор крезола в калийном мыле известен как препарат лизол, применяемый в качестве дезинфицирующего средства.
Берёзовый дёготь — одна из основных составных частей мази Вишневского, содержит в своем составе фенол. Препарат, используемый для лечения ран, обладает высоким антимикробным действием.
Значительное количество антисептиков представлено солями тяжёлых металлов. Их антимикробное действие связано с тем, что уже в довольно низких концентрациях они взаимодействуют с белками микроорганизмов, блокируют их SН-группы и изменяют их конформацию. Из-за высокой токсичности большинство лекарств, содержащих соли тяжёлых металлов, применяют в качестве поверхностных антисептиков.
Так, высокой антимикробной активностью обладает сулема — дихлорид ртути (HgCl2). Её используют для обработки рук и дезинфекции помещений. Случайное или преднамеренное отравление препаратами ртути вызывает тяжёлые некротические поражения слизистой оболочки пищеварительного тракта и некротические изменения в почках. Антимикробными свойствами обладают и препараты серебра, такие как ляпис (АgNO3), колларгол (серебро коллоидальное), применяемые для обработки слизистых оболочек при инфекционных заболеваниях.
Г. Супервторичная структура белков
Пространственная структура каждого белка индивидуальна и определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков. Супервторичная структура формируется за счёт межрадикальных взаимодействий.
Определённые характерные сочетания α-спиралей и β-структур часто обозначают как «структурные мотивы». Они имеют специфические названия: «α-спираль — поворот — α-спираль», «структура β-бочонка», «лейциновая застёжка- молния», «цинковый палец» и др. Специфическое пространственное расположение -α-спиралей и β-струкгур формируется за счёт межрадикальных взаимодействий.
1. Супервторичная структура типа β-бочонка
Такая структура действительно напоминает бочонок, где каждая β-структура (обозначенная на рис. 1-16 стрелкой) расположена внутри и связана с α-спиральным участком полипептидной цепи, находящимся на поверхности молекулы.
Супервторичную структуру в виде β-бочонка имеют некоторые ферменты, например, триозофосфатизомераза и один домен пируваткиназы (рис. 1-16).
Рис. 1-16. Супервторичная структура в виде β-бочонка. А - триозофосфатизомераза; Б - домен пируваткиназы.

2. Структурный мотив «α-спираль — поворот — α-спираль»
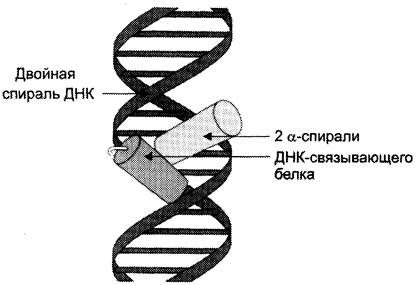
Этот «структурный мотив» обнаружен во многих ДНК-связывающих белках. Двухспиральная структура ДНК имеет две бороздки — большую и малую. Большая бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки.
В данный структурный мотив входят две α- спирали: одна более короткая, другая более длинная, которые соединены поворотом полипептидной цепи. Более короткая α-спираль располагается поперёк бороздки, а более длинная α-спираль — в большой бороздке, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК (рис. 1-17).
Рис. 1-17. Связывание супервторичной структуры «α-спираль-поворот-α-спираль» ДНК-связывающего белка в большой бороздке ДНК.
3. Супервторичная структура в виде «цинкового пальца»
Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. «Цинковый палец» — фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя — гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина (рис. 1-18).
Рис. 1-18. Фрагмент ДНК-связывающего белка в форме «цинкового пальца».

Два близко лежащих остатка цистеина отделены от двух других остатков гистидина (или цистеина) аминокислотной последовательностью, состоящей примерно из 12 аминокислотных остатков. Этот участок белка образует α-спираль, которая может специфично связываться с регуляторными участками большой бороздки ДНК. Специфичность взаимодействия ДНК-связывающего белка с определённой областью ДНК зависит от последовательности аминокислотных остатков, расположенных в области «цинкового пальца».
4. Супервторичная структура в виде «лейциновой застёжки-молнии»
Некоторые ДНК-связывающие белки олигомерны, т. е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застёжка-молния».
На поверхности каждой из двух взаимодействующих полипептидных цепей или белков имеется α-спиральный участок, содержащий по крайней мере 4 остатка лейцина. Лейциновые остатки располагаются через каждые 6 аминокислот один от другого. Так как каждый виток α-спирали содержит 3,6 аминокислотных остатка, радикалы лейцина находятся на поверхности каждого второго витка.
Лейциновые остатки α-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка с помощью гидрофобных взаимодействий, соединяя их вместе (рис. 1-19).
Рис. 1-19. «Лейциновая застёжка-молния» между α-спиральными участками двух белков.

Примером соединения белков с помощью «лейциновой застёжки-молнии» могут служить гистоны. Гистоны — ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот — аргинина и лизина. Молекулы гистонов объединяются в комплексы, состоящие из 8 мономерных белков с помощью «лейциновых застёжек», несмотря на то, что все мономеры имеют сильный положительный заряд.
Д. Доменная структура белков
Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Домен — участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка. Так, лёгкая цепь иммуноглобулина G состоит из двух доменов. В некоторых случаях доменами называют отдельные структурные участки полипептидной цепи.
Домены обычно можно выделить, действуя на белок протеолитическими ферментами, легко разрывающими пептидные связи на участке полипептидной цепи, расположенной между доменами. После этого некоторые домены могут сохранять свои биологические свойства.
Е. Четвертичная структура белков
Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например, дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок).
В то же время существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных.
Количество и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков». Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
1. Количество протомеров в структуре олигомерных белков
В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).
Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа — 4 протомера; фермент внутренней мембраны митохондрий цитохромоксидаза — 13 протомеров, а глутаминсинтетаза — 12 протомеров (рис. 1-20). Имеются также крупные многофункциональные комплексы, содержащие в своём составе несколько десятков полипептидных цепей, например, пируватдегидрогеназный комплекс состоит из 312 протомеров.
Рис. 1-20. Субъединичная структура глутаминсинтетазы.

Некоторые олигомерные белки содержат идентичные протомеры (например, гексокиназа), другие состоят из разных протомеров. Так, в составе гемоглобина присутствуют 2 α- и 2 β-протомера, а в составе лактатдегидрогеназы, имеющей 4 протомера, 2 типа мономеров (Н и М) в разных тканях могут находиться в разных сочетаниях (например, 4Н либо 3Н + 1М и т. д.).
Олигомерные белки имеют большую молекулярную массу. Белки с молекулярной массой более 50 000 Д практически всегда содержат несколько мономерных полипептидных цепей. По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции.
2. Сборка протомеров в олигомерный белок. Комплементарность протомеров
«Узнавание» и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом.
Специфичность связывания контактных участков определяется их комплементарностью. Комплементарность — пространственное и химическое соответствие взаимодействующих поверхностей. Впадины и выступы на поверхности одной молекулы должны совпадать с выступами и впадинами на поверхности другой молекулы, как два куска неровно разорванной бумаги. Кроме того, функциональные группы радикалов аминокислот на одной контактирующей поверхности должны образовывать слабые химические связи с радикалами аминокислот на другой поверхности (рис. 1-21). В области контактных поверхностей обычно содержится много гидрофобных радикалов аминокислот, в результате объединения которых формируется гидрофобное ядро олигомерного белка. Гидрофильные радикалы могут образовывать водородные и ионные связи.
Рис. 1-21. Схема образования димерной белковой молекулы. Между протомерами А и Б образуется множество слабых связей, обозначенных на рисунке чёрточками.

Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены.
Комплементарность — универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других (не обязательно белковых) молекул.