БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 7. ОБМЕН УГЛЕВОДОВ
VIII. Катаболизм глюкозы
Катаболизм глюкозы — основной поставщик энергии для процессов жизнедеятельности организма.
А. Основные пути катаболизма глюкозы
Окисление глюкозы до СО2 и Н2О (аэробный распад). Аэробный распад глюкозы можно выразить суммарным уравнением:
С6Н12О6 + 6 О2 —> 6 СО2 + Н2О + 2820 кДж/моль.
Этот процесс включает несколько стадий (рис. 7-33).
Рис. 7-33. Аэробный распад глюкозы. 1-10 — реакции аэробного гликолиза; 11 — малат-аспартатный челночный механизм транспорта водорода в митохондрии; 2 (в кружке) — стехиометрический коэффициент.

✵ Аэробный гликолиз — процесс окисления глюкозы с образованием двух молекул пирувата;
✵ Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в нитратном цикле;
✵ ЦПЭ на кислород, сопряжённая с реакциями дегидрирования, происходящими в процессе распада глюкозы.
Анаэробный распад
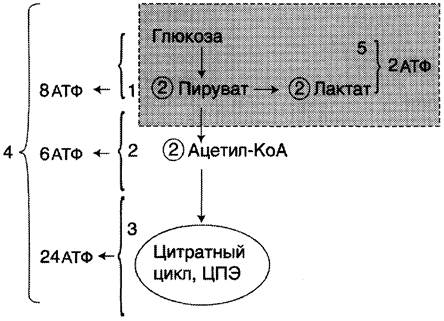
В определённых ситуациях обеспечение кислородом тканей может не соответствовать их потребностям. Например, на начальных стадиях интенсивной мышечной работы при стрессе сердечные сокращения могут не достигать нужной частоты, а потребности мышц в кислороде для аэробного распада глюкозы велики. В подобных случаях включается процесс, который протекает без кислорода и заканчивается образованием лактата из пировиноградной кислоты. Этот процесс называют анаэробным распадом, или анаэробным гликолизом. Анаэробный распад глюкозы энергетически малоэффективен, но именно этот процесс может стать единственным источником энергии для мышечной клетки в описанной ситуации. В дальнейшем, когда снабжение мышц кислородом будет достаточным в результате перехода сердца на ускоренный ритм, анаэробный распад переключается на аэробный. Пути катаболизма глюкозы и их энергетический эффект показаны на рис. 7-34.
Рис. 7-34. Пути катаболизма глюкозы. 1 — аэробный гликолиз; 2, 3 — общий путь катаболизма; 4 — аэробный распад глюкозы; 5 — анаэробный распад глюкозы (в рамке); 2 (в кружке) — стехиометрический коэффициент.
Б. Аэробный гликолиз
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий, в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
1. Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.
1. Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
2. Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
2. Реакции аэробного гликолиза
Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата
Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы.
Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6- бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
Фруктозо-1,6-бисфосфат далее расщепляется на 2 триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Реакцию катализирует фермент фруктозобисфосфатальдолаза, или просто альдолаза. Этот фермент катализирует как реакцию альдольного расщепления, так и альдольной конденсации, т. е. обратимую реакцию. Продукты реакции альдольного расщепления — изомеры. В последующих реакциях гликолиза используется только глицеральдегид-3-фосфат, поэтому дигидроксиацетонфосфат превращается с участием фермента триозофосфатизомеразы в глицероальдегид-3-фосфат (рис. 7-35).
Рис. 7-35. Превращение глюкозо-6-фосфата в триозофосфаты.

В описанной серии реакций дважды происходит фосфорилирование с использованием АТФ. Однако расходование двух молекул АТФ (на одну молекулу глюкозы) далее будет компенсировано синтезом большего количества АТФ.
Превращение глицеральдегид-3-фосфата в пируват
Эта часть аэробного гликолиза включает реакции, связанные с синтезом АТФ. Наиболее сложной в данной серии реакций является реакция превращения глицеральдегид-3-фосфата в 1,3- бисфосфоглицерат. Это превращение — первая реакция окисления в ходе гликолиза. Реакцию катализирует глицеральдегцд-3-фосфатдегидрогеназа, которая является NAD-зависимым ферментом. Значение данной реакции заключается не только в том, что образуется восстановленный кофермент, окисление которого в дыхательной цепи сопряжено с синтезом АТФ, но также и в том, что свободная энергия окисления концентрируется в макроэргической связи продукта реакции. Глицеральдегид-3-фосфатдегидрогеназа содержит в активном центре остаток цистеина, сульфгидрильная группа которого принимает непосредственное участие в катализе. Окисление глицеральдегид-3-фосфата приводит к восстановлению NAD и образованию с участием Н3РО4 высокоэнергетической ангидридной связи в 1,3-бис- фосфоглицерате в положении 1. В следующей реакции высокоэнергетический фосфат передаётся на АДФ с образованием АТФ. Фермент, катализирующий это превращение, назван по обратной реакции фосфоглицераткиназой (киназы называются по субстрату, находящемуся в уравнении реакции по одну сторону с АТФ). Данная серия реакций показана на рис. 7-36.
Рис. 7-36. Превращение глицеральдегид-3-фосфата в 3-фосфоглицерат.

Образование АТФ описанным способом не связано с дыхательной цепью, и его называют субстратным фосфорилированием АДФ. Образованный 3-фосфоглицерат уже не содержит макроэргической связи. В следующих реакциях происходят внутримолекулярные перестройки, смысл которых сводится к тому, что низкоэнергетический фосфоэфир переходит в соединение, содержащее высокоэнергетический фосфат. Внутримолекулярные преобразования заключаются в переносе фосфатного остатка из положения 3 в фосфоглицерате в положение 2. Затем от образовавшегося 2-фосфоглицерата отщепляется молекула воды при участии фермента енолазы. Название дегидратирующего фермента дано по обратной реакции. В результате реакции образуется замещённый енол — фосфоенолпируват. Образованный фосфоенолпируват — макроэргическое соединение, фосфатная группа которого переносится в следующей реакции на АДФ при участии пируваткиназы (фермент также назван по обратной реакции, в которой происходит фосфорилирование пиру- вата, хотя подобная реакция в таком виде не имеет места).
Превращение фосфоенолпирувата в пируват — необратимая реакция. Это вторая в ходе гликолиза реакция субстратного фосфорилирования. Образующаяся енольная форма пирувата затем неферментативно переходит в более термодинамически стабильную кетоформу. Описанная серия реакций представлена на рис. 7-37.
Рис. 7-37. Превращение 3-фосфоглицерата в пируват.

Схема 10 реакций, протекающих при аэробном гликолизе, и дальнейшее окисление пирувата представлены на рис. 7-33.
3. Окисление цитоплазматического NАDН в митохондриальной дыхательной цепи. Челночные системы
NADH, образующийся при окислении глицер- альдегид-3-фосфата в аэробном гликолизе, подвергается окислению путём переноса атомов водорода в митохондриальную дыхательную цепь. Однако цитозольный NADH не способен передавать водород на дыхательную цепь, потому что митохондриальная мембрана для него непроницаема. Перенос водорода через мембрану происходит с помощью специальных систем, называемых «челночными». В этих системах водород транспортируется через мембрану при участии пар субстратов, связанных соответствующими дегидрогеназами, т.е. с обеих сторон митохондриальной мембраны находится специфическая дегидрогеназа. Известны 2 челночные системы. В первой из этих систем водород от NADH в цитозоле передаётся на дигидроксиацетонфосфат ферментом глицерол-3-фосфатдегидрогеназой (NAD-зависимый фермент, назван по обратной реакции). Образованный в ходе этой реакции глицерол-3-фосфат, окисляется далее ферментом' внутренней мембраны митохондрий — глицерол-3-фосфатдегидрогеназой (FAD- зависимым ферментом). Затем протоны и электроны с FADH2 переходят на убихинон и далее по ЦПЭ (рис. 7-38).
Рис. 7-38. Глицерофосфатная челночная система. 1 — глицеральдегид-3-фосфатдегидрогеназа; 2 — глицерол-3-фосфатдегидрогеназа (цитозольный фермент, назван по обратной реакции); 3 — глицерол-3-фосфатдегидрогеназа (митохондриальный флавиновый фермент).
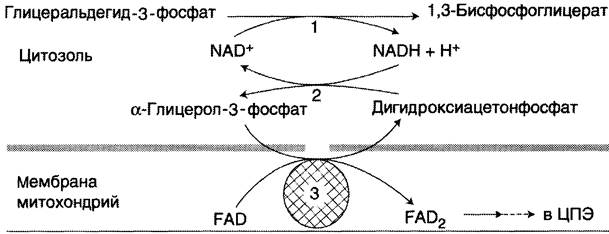
Глицеролфосфатная челночная система работает в клетках белых мышц и гепатоцитов. Однако в клетках сердечных мышц митохондриальная глицерол-3-фосфатдегидрогеназа отсутствует. Вторая челночная система, в которой участвуют малат, цитозольная и митохондриальная малат- дегидрогеназы, является более универсальной. В цитоплазме NADH восстанавливает оксалоа- цетат в малат (рис. 7-39, реакция 1), который при участии переносчика проходит в митохондрии, где окисляется в оксалоацетат NAD-зави- симой малатдегидрогеназой (реакция 2). Восстановленный в ходе этой реакции NAD отдаёт водород в митохондриальную ЦПЭ. Однако образованный из малата оксалоацетат выйти самостоятельно из митохондрий в цитозоль не может, так как мембрана митохондрий для него непроницаема. Поэтому оксалоацетат превращается в аспартат, который и транспортируется в цитозоль, где снова превращается в оксалоацетат. Превращения оксалоацетата в аспартат и обратно связаны с присоединением и отщеплением аминогруппы (реакции трансаминирования, см. раздел 9). Эта челночная система называется малат-аспартатной (рис. 7-39). Результат её работы — регенерация цитоплазматического NAD+ из NADH.
Рис. 7-39. Малат-аспартатная челночная система. 1,2 — окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на ЦПЭ; 3, 4 — транслоказы, обеспечивающие транспорт α-кетоглутарата, аспартата и глутамата и через мембрану митохондрий.

Обе челночные системы существенно отличаются по количеству синтезированного АТФ. В первой системе соотношение P/О равно 2, так как водород вводится в ЦПЭ на уровне KoQ. Вторая система энергетически более эффективна, так как передаёт водород в ЦПЭ через митохондриальный NAD+ и соотношение Р/О близко к 3.
4. Баланс АТФ при аэробном гликолизе и распаде глюкозы до СO2 и Н2O
Выход АТФ при аэробном гликолизе
На образование фруктозо-1,6-бисфосфата из одной молекулы глюкозы требуется 2 молекулы АТФ (реакции 1 и 3 на рис. 7-33). Реакции, связанные с синтезом АТФ, происходят после распада глюкозы на 2 молекулы фосфотриозы, т. е. на втором этапе гликолиза. На этом этапе происходят 2 реакции субстратного фосфорилирования и синтезируются 2 молекулы АТФ (реакции 7 и 10). Кроме того, одна молекула глицеральдегид-3-фосфата дегидрируется (реакция 6), а NADH передаёт водород в митохондриальную ЦПЭ, где синтезируется 3 молекулы АТФ путём окислительного фосфорилирования. В данном случае количество АТФ (3 или 2) зависит от типа челночной системы. Следовательно, окисление до пирувата одной молекулы глицеральдегид-3-фосфата сопряжено с синтезом 5 молекул АТФ. Учитывая, что из глюкозы образуются 2 молекулы фосфотриозы, полученную величину нужно умножить на 2 и затем вычесть 2 молекулы АТФ, затраченные на первом этапе. Таким образом, выход АТФ при аэробном гликолизе составляет (5 x2) - 2 = 8 АТФ.
Выход АТФ при аэробном распаде глюкозы до конечных продуктов
В результате гликолиза образуется пируват, который далее окисляется до СO2 и Н2O в ОПК, описанном в разделе 6. Теперь можно оценить энергетическую эффективность гликолиза и ОПК, которые вместе составляют процесс аэробного распада глюкозы до конечных продуктов (табл. 7-4).
Таблица 7-4. Этапы аэробного распада глюкозы
Этапы аэробного распада глюкозы |
Количество использованного АТФ, моль |
Количество синтезированного АТФ, моль |
I. Аэробный гликолиз Глюкоза —> 2 Пируват |
-2 |
+ 10 |
II. Окислительное декарбоксилирование пирувата 2 (Пируват —> Ацетил-КоА) |
— |
+6 |
III. Цитратный цикл 2 (Ацетил-КоА —> СО2 + Н2О) Суммарный выход АТФ при окислении 1 моль глюкозы |
+24 +38 |
Таким образом, выход АТФ при окислении 1 моль глюкозы до СO2 и Н2O составляет 38 моль АТФ.
В процессе аэробного распада глюкозы происходят 6 реакций дегидрирования. Одна из них протекает в гликолизе и 5 в ОПК (см. раздел 6). Субстраты для специфических NAD-зaвиcимыx дегидрогеназ: глицеральдегид-3-фосфат, пируват, изоцитрат, α-кетоглутарат, малат. Одна реакция дегидрирования в цитратном цикле под действием сукцинатдегидрогеназы происходит с участием кофермента FAD. Общее количество АТФ, синтезированное путём окислительного фофорилирования, составляет 17 моль АТФ на 1 моль глицеральдегидфосфата. К этому необходимо прибавить 3 моль АТФ, синтезированных путём субстратного фосфорилирования (две реакции в гликолизе и одна в цитратном цикле).
Учитывая, что глюкоза распадается на 2 фосфотриозы и что стехиометрический коэффициент дальнейших превращений равен 2, полученную величину надо умножить на 2, а из результата вычесть 2 моль АТФ, использованные на первом этапе гликолиза.
В. Анаэробный распад глюкозы (анаэробный гликолиз)
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
С6Н12О6 + 2 Н3РО4 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2О.
1. Реакции анаэробного гликолиза
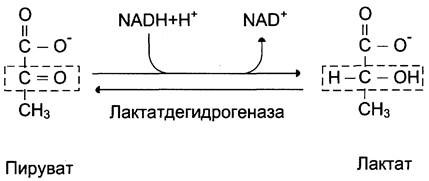
При анаэробном гликолизе (рис. 7-40) в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза (рис. 7-41). Восстановление пирувата в лактат катализирует лактатдегидрогеназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD+ из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NADf. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О. Строение лактатдегидрогеназы, механизм действия и значение определения активности этого фермента для диагностики заболеваний описывались ранее в разделе 2.
Рис. 7-40. Анаэробный гликолиз.

Рис. 7-41. Восстановление пирувата в лактат.
Баланс АТФ при анаэробном гликолизе
Анаэробный гликолиз по сравнению с аэробным менее эффективен. В этом процессе катаболизм 1 моль глюкозы без участия митохондриальной дыхательной цепи сопровождается синтезом 2 моль АТФ и 2 моль лактата. АТФ образуется за счёт 2 реакций субстратного фосфорилирования. Поскольку глюкоза распадается на 2 фосфотриозы, то с учётом стехиометрического коэффициента, равного 2, количество моль синтезированного АТФ равно 4. Учитывая 2 моль АТФ, использованных на первом этапе гликолиза, получаем конечный энергетический эффект процесса, равный 2 моль АТФ. Таким образом, 10 цитозольных ферментов, катализирующих превращение глюкозы в пиру- ват, вместе с лактатдегидрогеназой обеспечивают в анаэробном гликолизе синтез 2 моль АТФ (на 1 моль глюкозы) без участия кислорода.
Г. Значение катаболизма глюкозы
Основное физиологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе для синтеза АТФ.
Энергия, выделяющаяся в процессе полного распада глюкозы до СО2 и Н2О, составляет 2880 кДж/моль. Если эту величину сравнить с энергией гидролиза высокоэнергетических связей — 38 моль АТФ (50 кДж на моль АТФ), то получим: 50 x 38 = 1900 кДж, что составляет 65% от всей энергии, выделяющейся при полном распаде глюкозы. Такова эффективность использования энергии распада глюкозы для синтеза АТФ. Необходимо учитывать, что реальная эффективность процесса может быть ниже. Точно оценить выход АТФ можно только при субстратном фосфорилировании, а соотношение между поступлением водорода в дыхательную цепь и синтезом АТФ является приблизительным.
Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя её аэробным путём. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания).
Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение как аэробного, так и анаэробного гликолиза. Но преимущественный анаэробный гликолиз и увеличение синтеза лактата служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов.
Кроме энергетической функции, процесс катаболизма глюкозы может выполнять и анаболические функции. Метаболиты гликолиза используются для синтеза новых соединений. Так, фруктозо-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата — структурного компонента нуклеотидов; 3-фосфоглицерат может включаться в синтез аминокислот, таких как серин, глицин, цистеин (см. раздел 9). В печени и жировой ткани ацетил-КоА, образующийся из пирувата, используется как субстрат при биосинтезе жирных кислот, холестерина, а дигидроксиацетонфосфат как субстрат для синтеза глицерол-3-фосфата (см. раздел 8).
Д. Регуляция катаболизма глюкозы
Поскольку основное значение гликолиза состоит в синтезе АТФ, его скорость должна коррелировать с затратами энергии в организме.
Большинство реакций гликолиза обратимы, за исключением трёх, катализируемых гексокиназой (или глюкокиназой), фосфофруктокиназой и пируваткиназой. Регуляторные факторы, изменяющие скорость гликолиза, а значит и образование АТФ, направлены на необратимые реакции. Показателем потребления АТФ является накопление АДФ и АМФ. Последний образуется в реакции, катализируемой аденилаткиназой: 2 АДФ <-> АМФ + АТФ
Даже небольшой расход АТФ ведёт к заметному увеличению АМФ. Отношение уровня АТФ к АДФ и АМФ характеризует энергетический статус клетки (см. раздел 6), а его составляющие служат аллостерическими регуляторами скорости как общего пути катаболизма, так и гликолиза. На рисунке 7-42 показана аллостерическая регуляция скорости катаболизма глюкозы в скелетных мышцах.
Рис. 7-42. Регуляция катаболизма глюкозы в скелетных мышцах.
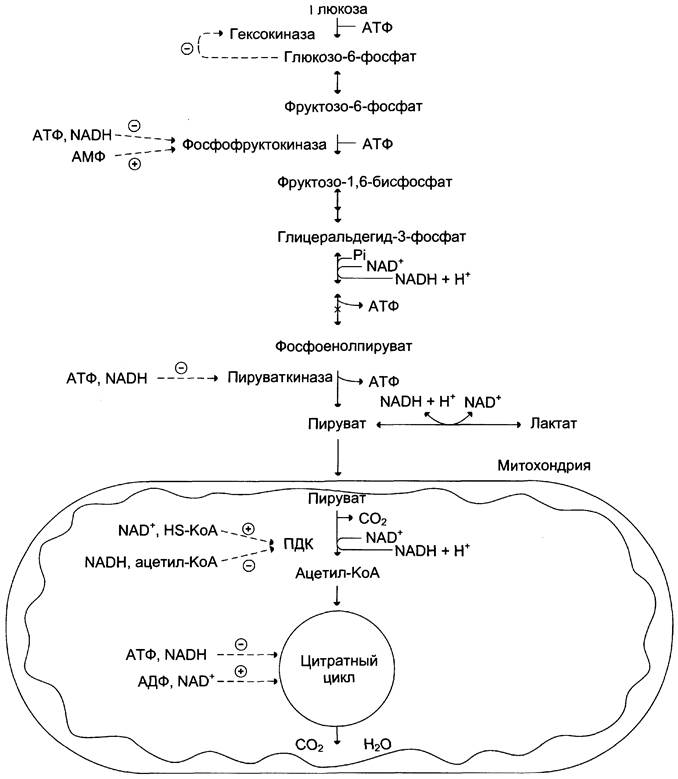
Существенное значение для регуляции гликолиза имеет изменение активности фосфофруктокиназы, потому что этот фермент, как упоминалось ранее, катализирует наиболее медленную реакцию процесса.
Фосфофруктокиназа активируется АМФ, но ингибируется АТФ. АМФ, связываясь с аллостерическим центром фосфофруктокиназы, увеличивает сродство фермента к фруктозо-6-фосфату и повышает скорость его фосфорилирования. Эффект АТФ на этот фермент — пример гомотропного аллостеризма (см. раздел 2), поскольку АТФ может взаимодействовать как с аллостерическим, так и с активным центром, в последнем случае как субстрат.
При физиологических значениях АТФ активный центр фосфофруктокиназы всегда насыщен субстратами (в том числе АТФ). Повышение уровня АТФ относительно АДФ снижает скорость реакции, поскольку АТФ в этих условиях действует как ингибитор: связывается с аллостерическим центром фермента, вызывает конформационные изменения и уменьшает сродство к его субстратам.
Изменение активности фосфофруктокиназы способствует регуляции скорости фосфорилирования глюкозы гексокиназой. Снижение активности фосфофруктокиназы при высоком уровне АТФ ведёт к накоплению как фруктозо-6-фосфата, так и глюкозо-6-фосфата, а последний ингибирует гексокиназу. Следует напомнить, что гексокиназа во многих тканях (за исключением печени и β-клеток поджелудочной железы) ингибируется глюкозо-6-фосфатом.
При высоком уровне АТФ снижается скорость цикла лимонной кислоты и дыхательной цепи. В этих условиях процесс гликолиза также замедляется. Следует напомнить, что аллостерическая регуляция ферментов ОПК и дыхательной цепи также связана с изменением концентрации таких ключевых продуктов, как NАDН, АТФ и некоторых метаболитов. Так, NАDН, накапливаясь в том случае, если не успевает окислиться в дыхательной цепи, ингибирует некоторые аллостерические ферменты нитратного цикла (см. раздел 6).
Физиологическая роль гликолиза в печени и жировой ткани несколько иная, чем в других тканях. В печени и жировой ткани гликолиз в период пищеварения функционирует в основном как источник субстратов для синтеза жиров. Регуляция гликолиза в печени имеет свои особенности и будет рассмотрена позже.
Е. 2,3-бисфосфоглицератный цикл
В гликолитическом пути может протекать дополнительная реакция, катализируемая бисфосфоглицератмутазой, превращающей 1,3-бисфосфоглицерат в 2,3-бисфосфоглицерат (2,3-БФГ), который может при участии 2,3-бисфосфогли- цератфосфатазы превращаться в 3-фосфоглицерат — метаболит гликолиза (рис. 7-43).
Рис. 7-43. Образование и превращение 2,3-бисфосфоглицерата.
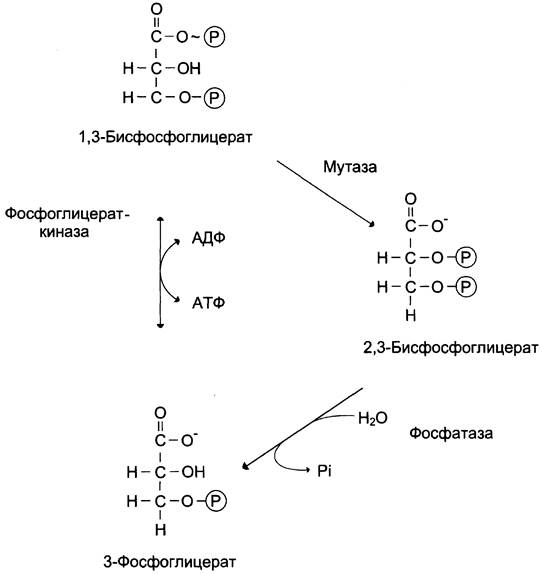
В большинстве тканей 2,3-БФГ образуется в небольших количествах. В эритроцитах этот метаболит образуется в значительных количествах и выполняет роль аллостерического регулятора функции гемоглобина. 2,3-БФГ, связываясь с гемоглобином, понижает его сродство к кислороду, способствует диссоциации кислорода и переходу его в ткани (см. раздел 1).
Образование 2,3-БФГ предполагает потерю энергии макроэргической связи в 1,3-бисфосфоглицерате, которая не переносится на АТФ, а рассеивается в форме теплоты, что означает снижение энергетического эффекта гликолиза.