БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 10. ОБМЕН НУКЛЕОТИДОВ
II. Синтез пуриновых нуклеотидов
В 40-50-х годах XX столетия опытами с мечеными изотопами удалось выяснить происхождение атомов пуринового ядра при синтезе пуринов de novo. Было установлено, что в формировании кольца принимают участие аминокислоты Асп, Гли, Глн, СО2 и два одноуглеродных производных тетрагидрофолата: метенил-Н4-фолат и формил-Н4-фолат. Этим способом образуется основное количество пуриновых нуклеотидов, тогда как нуклеотиды, синтезирующиеся за счёт повторного использования азотистых оснований или нуклеозидов, составляют не более 10 — 20% общего фонда этих соединений.
А. Образование 5-фосфорибозил-1-дифосфата
Фосфорибозилдифосфат (ФРДФ), или фосфорибозилпирофосфат (ФРПФ) занимает центральное место в синтезе как пуриновых, так и пиримидиновых нуклеотидов (рис. 10-2).
Рис. 10-2. Образование 5-фосфорибозил-1-дифосфата.

Он образуется за счёт переноса β, y-пирофосфатного остатка АТФ на рибозо-5-фосфат в реакции, катализируемой ФРДФ-синтетазой.
Источниками рибозо-5-фосфата могут быть: пентозофосфатный путь превращения глюкозы или катаболизм нуклеозидов, в ходе которого под действием нуклеозидфосфорилазы первоначально образуется рибозо-1-фосфат, а затем с помощью, соответствующей мутазы фосфатный остаток переносится в 5-положение.
ФРДФ участвует не только в синтезе пуриновых и пиримидиновых нуклеотидов из простых предшественников (т. е. de novo), но используется на образование пуриновых нуклеотидов по «запасному» пути и в синтезе нуклеотидных коферментов.
Б. Биосинтез пуриновых нуклеотидов de novo
Сборка пуринового гетероцикла осуществляется на остатке рибозо-5-фосфата при участии различных доноров углерода и азота (рис. 10-3).
Рис. 10-3. Происхождение атомов С и N в пуриновом кольце.
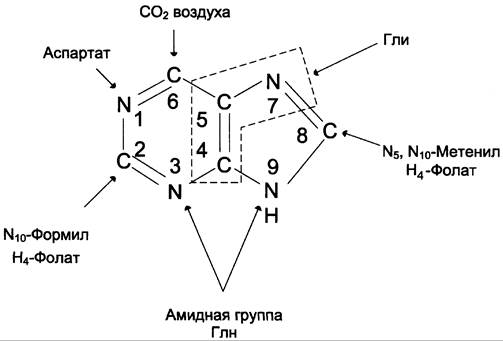
Включение простых предшественников в пуриновое кольцо с образованием ИМФ
Первая специфическая реакция образования пуриновых нуклеотидов — перенос амидной группы Глн на ФРДФ с образованием 5-фосфорибозил-1-амина (рис. 10-4). Эту реакцию катализирует фермент амидофосфорибозилтрансфераза. При этом формируется β-N-гликозидная связь.
Рис. 10-4. Синтез пуриновых нуклеотидов de novo.

Затем к аминогруппе 5-фосфорибозил-1 -амина присоединяются остаток глицина, N5, N10-метенил-Н4-фолата ещё одна амидная группа глутамина, диоксид углерода, аминогруппа аспартата и формильный остаток N10-формил Н4-фолата.
Результатом этой десятистадийной серии реакций является образование первого пуринового нуклеотида — инозин-5'-монофосфата (ИМФ), на синтез которого затрачивается не менее шести молекул АТФ. В отличие от прокариотов, у которых каждую стадию этого процесса катализирует отдельный фермент, у эукариотов за
счёт слияния генов возникли полифункциональные ферменты, каждый из которых катализирует несколько реакций. В синтезе пуриновых нуклеотидов de novo это реакции 3, 4 и 6, 7 — 8 и 10 — 11 соответственно.
ИМФ в основном используется на синтез АМФ или ГМФ. Небольшое количество этого продукта обнаруживается также в тРНК в качестве одного из минорных нуклеотидов.
Превращение ИМФ в АМФ и ГМФ в обоих случаях включает 2 стадии и идёт с затратой энергии (рис. 10-5).
Рис. 10-5. Синтез АМФ и ГМФ из ИМФ. 1 — аденилосукцинатсинтетаза; 2 — аденилосукциназа; 3 — ИМФ-дегидрогеназа; 4 — ГМФ-синтетаза.

Аденилосукцинатсинтетаза, используя энергию ГТФ, присоединяет аспартат к ИМФ с образованием аденилосукцината, который в реакции, катализируемой аденилосукциназой, отщепляет фумарат и превращается в АМФ.
Второй пуриновый нуклеотид (ГМФ) образуется также в 2 стадии. Сначала ИМФ окисляется NAD+-зависимой ИМФ-дегидрогеназой с образованием ксантозин-5'-монофосфата (КМФ). Последующее трансамидирование гидроксильной группы при С2-пуринового кольца КМФ катализирует ГМФ-синтетаза с использованием амидной группы Глн и энергии АТФ.
При образовании пуриновых нуклеотидов ГТФ расходуется на синтез АМФ, а АТФ — на синтез ГМФ. Перекрёстное использование пуриновых нуклеозидтрифосфатов на образование конечных продуктов синтеза помогает поддерживать в клетках баланс адениловых и гуаниловых нуклеотидов.
Печень — основное место образования пуриновых нуклеотидов, откуда они могут поступать в ткани, не способные к их синтезу: эритроциты, ПЯЛ и частично мозг.
Образование нуклеозид- ди- и трифосфатов
В образовании нуклеиновых кислот, некоторых коферментов и во многих синтетических процессах нуклеотиды используются в виде ди- и трифосфатов, синтез которых катализируют ферменты класса трансфераз. АМФ и ГМФ превращаются в нуклеозиддифосфаты (НДФ) с помощью специфичных к азотистому основанию нуклеозидмонофосфаткиназ (НМФ-киназ) и АТФ. Так, аденилаткиназа катализирует реакцию:
АМФ + АТФ —> 2 АДФ,
а гуанилаткиназа:
ГМФ + АТФ —> ГДФ + АДФ.
Аденилаткиназа особенно активна в печени и мышцах, где высок уровень энергоёмких процессов. Функция этого фермента заключается в том, чтобы поддерживать в тканях равновесие фонда адениловых нуклеотидов: АМФ, АДФ и АТФ.
Взаимопревращения нуклеозиддифосфатов и нуклеозидтрифосфатов осуществляет нуклеозид- дифосфаткиназа. Этот фермент в отличие от НМФ-киназ обладает широкой субстратной специфичностью и, в частности, может катализировать реакцию:
ГДФ + АТФ —> ГТФ + АДФ.
Превращение АДФ в АТФ происходит, в основном, за счёт окислительного фосфорилирования или в реакциях субстратного фосфорилирования гликолиза или цитратного цикла.
В. ‹Запасные› пути синтеза пуриновых нуклеотидов (реутилизация азотистых оснований и нуклеозидов)
Огромные затраты энергии для синтеза пуриновых нуклеотидов de novo не способны полностью обеспечить субстратами синтез нуклеиновых кислот в период гаструляции и раннего роста ребёнка. Потребность в большом количестве нуклеотидов привела к развитию «запасных» путей синтеза этих «дорогих» молекул. Наибольшее значение в этом процессе имеют ферменты, осуществляющие превращение пуринов в мононуклеотиды с использованием ФРДФ как донора остатка фосфорибозы.
Синтез АМФ и ГМФ из аденина и гуанина
ФРДФ-зависимое фосфорибозилирование пуринов катализируют 2 фермента.
Аденинфосфорибозилтрансфераза, ответственная за образование АМФ (рис. 10-6).
Рис. 10-6. Фосфорибозилирование аденина в АМФ.

Гипоксантин-гуанинфосфорибозилтрансфераза, катализирующая образование ИМФ и ГМФ из гипоксантина и гуанина соответственно (рис. 10-7).
Рис. 10-7. Фосфорибозилирование гипоксантина и гуанина с образованием ИМФ и ГМФ.

Однако в организме при любых ситуациях этот путь синтеза пуриновых нуклеотидов, получивший название «путь спасения», имеет вспомогательное значение.
Нуклеозидкиназы
Нуклеозиды, получающиеся при катаболизме нуклеиновых кислот из нуклеотидов под действием нуклеотидаз, могут повторно фосфорилироваться, образуя нуклеозид-5'-монофосфаты за счёт переноса y-фосфатного остатка АТФ на соответствующий субстрат. У млекопитающих такой путь пополнения запасов пуриновых нуклеотидов в клетке не имеет существенного значения. Основным ферментом этой группы является аденозин- киназа, которая ускоряет реакцию:
Аденозин + АТФ —> АМФ + АДФ.
Из всех способов реутилизации пуринов наиболее активна гипоксантин-гуанинфосфорибозилтрансферазная реакция, поскольку ИМФ, образующийся в этой реакции, вовлекается в синтез АМФ и ГМФ. Использование гипоксантина и гуанина по запасному пути становится жизненно важным событием в клетках, не способных к синтезу пуриновых нуклеотидов de novo. Значение аденинфосфорибозилтрансферазы в повторном использовании аденина менее существенно. По сравнению с аденозином количество аденина в клетках мало, а первый возвращается в фонд нуклеотидов с помощью аденозинкиназы.
Г. Регуляция синтеза пуриновых нуклеотидов
Основным показателем, от которого зависит синтез пуриновых нуклеотидов, служит концентрация ФРДФ, которая, в свою очередь, зависит от скорости его синтеза, утилизации и разрушения. Количество ФРДФ определяется доступностью рибозо-5-фосфата и активностью ФРДФ синтетазы — фермента, чувствительного к концентрации фосфата и пуриновых нуклеотидов.
Внутриклеточная концентрация ФРДФ строго регулируется и обычно низкая. ФРДФ синтетаза — аллостерический фермент. Он активируется неорганическим фосфатом (Рi) и ингибируется пуриновыми нуклеозид- моно-, ди- и трифосфатами, которые по эффективности ингибирования распределяются в следующем по-
рядке: НМФ> НДФ> НТФ (рис. 10-8). ФРДФ служит не только субстратом, но и аллостерическим активатором второй реакции синтеза пуринонуклеотидов de novo, которую катализирует амидофосфорибозилтрансфераза.
Рис. 10-8. Регуляция синтеза пуриновых нуклеотидов. 1 — ФРДФ синтетаза; 2 — амидофосфорибозилтрансфераза; 3 — ИМФ дегидрогеназа; 4 — аденилосукцинатсинтетаза.

Пуриновые нуклеотиды, особенно АМФ и ГМФ по механизму отрицательной обратной связи ингибируют амидофосфорибозилтрансферазу, которая катализирует первую специфическую реакцию синтеза пуриновых нуклеотидов de novo.
Метаболическая цепь образования АМФ и ГМФ de novo регулируется также в месте её разветвления: АМФ ингибирует аденилосукцинат- синтетазу, а ГМФ — реакцию образования ксантиловой кислоты, которую катализирует ИМФ дегидрогеназа. Перекрёстная регуляция путей использования ИМФ служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого.
Помимо ферментов основного пути синтеза пуриновых нуклеотидов de novo, регулируется также активность ферментов «запасных» путей: аденинфосфорибозилтрансфераза ингибируется АМФ, а гипоксантин-гуанинфосфорибозилтрансфераза — ИМФ и ГМФ.
В различных клетках организма синтезируется до 90% пуриновых и пиримидиновых нуклеотидов из простых предшественников de novo. Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым «запасным» путям.