БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 10. ОБМЕН НУКЛЕОТИДОВ
VIII. Биосинтез дезоксирибонуклеотидов
Синтез дезоксирибонуклеотидов идёт с заметной скоростью только в тех клетках, которые вступают в S-фазу клеточного цикла и готовятся к синтезу ДНК и делению. В покоящихся клетках дезоксинуклеотиды практически отсутствуют. Все дезоксинуклеотиды, кроме тимидиловых, образуются из рибонуклеотидов путём прямого восстановления ОН-группы у второго углеродного атома рибозы в составе рибонуклеозиддифосфатов до дезоксирибозы. Тимидиловые нуклеотиды синтезируются из dУМФ особым путём с участием N5, N10-метилен-Н4-фолата.
А. Рибонуклеотидредуктазный комплекс
Реакцию восстановления НДФ в дезоксипроизводные катализирует рибонуклеотидредуктазный комплекс, в состав которого входят: собственно, рибонуклеотидредуктаза (РНР), белок тиоредоксин и фермент тиоредоксинредуктаза, обеспечивающий регенерацию восстановленной формы тиоредоксина (рис. 10-17).
Рибонуклеотидредуктаза — олигомерный белок, состоящий из двух В1- и двух В2-субъединиц, и содержит негеминовое железо в качестве кофактора.
Рис. 10-17. Восстановление рибонуклеозиддифосфатов в 2-дезоксирибонуклеозиддифосфаты. 1 — рибонуклеотидредуктаза (РНР); 2 — тиоредоксинредуктаза.
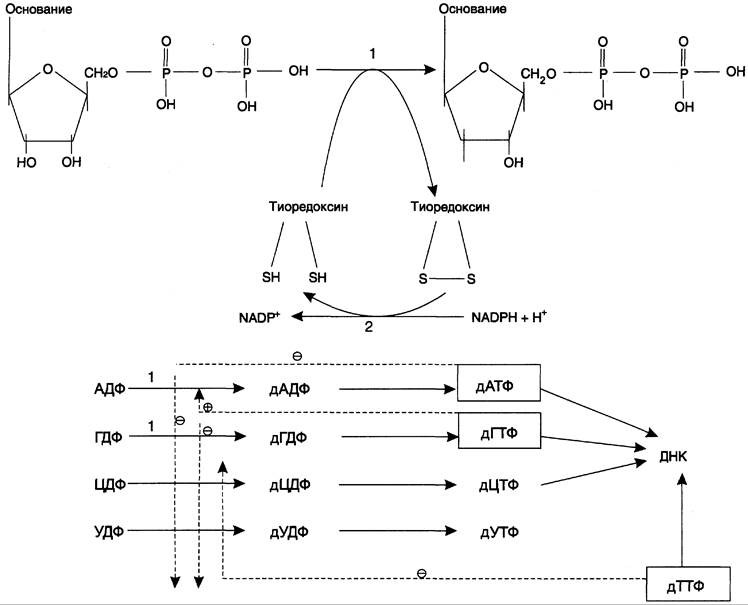
Непосредственным донором водорода в реакции восстановления рибозы служит низкомолекулярный белок тиоредоксин. В рабочую часть этого белка входят 2 SH-группы, которые, отдавая водород, окисляются с образованием дисульфидного мостика. Второй фермент комплекса — тиоредоксинредуктаза — катализирует гидрирование окисленного тиоредоксина с использованием NADPH.
При участии комплекса РНР образуются: dАДФ, dГДФ, dУДФ и dЦДФ, которые с помощью НДФ-киназ превращаются в дНТФ, 3 из которых (кроме дУДФ) непосредственно используются в синтезе ДНК.
дНДФ + АТФ —> дНТФ + АДФ.
Б. Биосинтез тимидиловых нуклеотидов
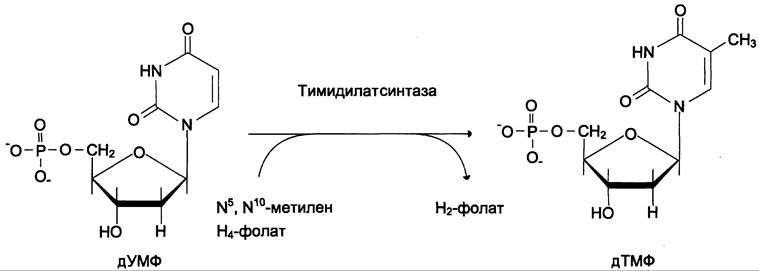
Тимидин-5'-монофосфат (дТМФ) образуется из дУМФ в реакции, катализируемой тимидилатсинтазой (рис. 10-18). Донором метальной группы, появляющейся в 5-положении пиримидинового кольца в молекуле дТМФ, служит кофермент тимидилатсинтазы — N5, N10-мeтилен-Н4-фолат. С помощью этого кофермента в молекулу дУМФ включается метиленовая группа и восстанавливается в метальную, используя 2 атома водорода от Н4-фолата.
Рис. 10-18. Синтез дТМФ из дУМФ.
Образование субстрата тимидилатсинтазной реакции — дУМФ осуществляется двумя путями (рис. 10-19):
✵ дефосфорилированием дУДФ;
✵ гидролитическим дезаминированием дЦМФ с помощью дЦМФ дезаминазы. дЦМФ получается при дефосфорилировании дЦДФ — одного из продуктов рибонуклеотидредуктазной реакции. В организме человека это — основной путь образования дУМФ.
Рис. 10-19. Образование ТТФ из дЦДФ и дУДФ. 1 — дЦМФ дезаминаза; 2 —тимидилатсинтаза; 3 — дНМФ- и дНДФ киназы; 4 — дигидрофолатредуктаза; 5 — серингидроксиметилтрансфераза.

Скорость синтеза дТМФ зависит также от количества второго субстрата тимидилатсинтазной реакции — N5, N10-метилен-Н4-фолата, пополнение запасов которого осуществляется при участии 2 ферментов: дигидрофолатредуктазы, которая с участием NADPH восстанавливает Н2- фолат в Н4-фолат, и серин гидроксиметилтрансферазы, осуществляющей перенос β-гидроксиметиленовой группы серина на Н4-фолат (см. раздел 9). У человека дТМФ образуется, главным образом, из дЦДФ.
В. ‹Запасные› пути синтеза дезоксирибонуклеотидов
В быстроделящихся клетках наряду с синтезом дезоксинуклеотидов с помощью рибонуклеотид- редуктазного комплекса и тимидилатсинтазы активируются реакции, обеспечивающие повторное использование тимина и дезоксицитидина в реакциях, катализируемых ферментами «запасных» путей и обратимых реакций катаболизма. Под влиянием тимидинфосфорилазы протекает следующая реакция:
Тимин + Дезоксирибоза-1-фосфат —> Тимидин + Н3РО4.
Тимидинкиназа катализирует следующую реакцию:
Тимидин + АТФ —> дТМФ + АДФ.
Дезоксицитидинкиназа катализирует следующую реакцию:
Дезоксицитидин + АТФ —> дЦМФ + АДФ.
Г. Регуляция синтеза дезоксирибонуклеотидов
Рибонуклеотидредуктаза, тимидилатсинтаза и тимидинкиназа — индуцируемые ферменты, их количество в клетке регулируется на генетическом уровне по механизму индукции и репрессии. Синтез этих белков начинает нарастать в G1-периоде, достигает максимума во время активного синтеза ДНК, снижаясь практически до нуля в G2- и М-периоды клеточного цикла.
В то же время активность РНР подвержена сложной аллостерической регуляции, с помощью которой достигается сбалансированное образование всех дНДФ.
РНР осуществляет последовательное восстановление всех рибонуклеозиддифосфатов. Первыми восстанавливаются пиримидиновые нуклеотиды, а последним — дАДФ. дАДФ фосфорилируется в дАТФ, накопление которого полностью прекращает восстановление всех остальных рибонуклеозиддифосфатов.
Д. Нарушения в работе РНР, вызванные недостаточностью ферментов катаболизма пуриннуклеозидов
Аденозиндезаминаза (АДА) и пурин нуклеозид- фосфорилаза (ПНФ) участвуют в превращении пуриновых нуклеозидов в азотистые основания. Их недостаточность сопровождается развитием тяжёлых форм иммунодефицита.
Недостаточность аденозиндезаминазы. АДА катализирует гидролитическое дезаминирование аденозина и дезоксиаденозина:
Аденозин + Н2О —> Инозин + NH3,
Дезоксиаденозин + Н2О —> Дезоксиинозин + NH3.
Фермент АДА обнаружен во многих органах и тканях, однако его недостаточность имеет наиболее тяжёлые последствия для клеток лимфоцитарного ряда. Низкая активность этого фермента нарушает пролиферацию и созревание Т- и В- лимфоцитов и сопровождается тяжёлыми формами клеточного и гуморального иммунодефицита. Дети, страдающие этой патологией, как правило, погибают в раннем возрасте от бактериальных, вирусных или грибковых инфекций.
Столь тяжёлые последствия недостаточности АДА для клеток лимфоцитарного ряда объясняют тем, что при снижении скорости дезаминирования адениловых и дезоксиадениловых нуклеотидов в клетках увеличивается концентрация дАТФ, который ингибирует РНР. Это нарушает синтез всех дНТФ и лишает клетки субстратов для синтеза ДНК. Для нелимфоцитарных клеток недостаточность АДА не сопровождается нарушениями метаболизма в связи с тем, что в них активно работает фосфатаза дАТФ, которая предотвращает накопление основного ингибитора РНР - дАТФ.
Фермент обладает групповой субстратной специфичностью и использует в качестве субстратов некоторые производные аденозина, которые применяются в терапии онкологических и противовирусных заболеваний (аденозинарабинозид, формицин).
Недостаточность пуриннуклеозидфосфорилазы (ПНФ). ПНФ катализирует фосфоролиз пуриновых рибо- и дезоксирибонуклеозидов с освобождением азотистых оснований и рибозо- или дезоксирибозо-1 -фосфата. Субстратами служат гуанозин, дезоксигуанозин и инозин.
Нуклеозид + Н3РО4 —> Азотистое основание + Рибозо-1-фосфат.
Фермент обнаружен во многих органах и тканях, но особенно активен в клетках-предшественниках Т-лимфоцитов в процессе их созревания в тимусе. При наследственной недостаточности пуриннуклеозидфосфорилазы, вызванной генными мутациями, в крови снижается образование и количество зрелых Т-лимфоцитов. Нарушение созревания Т-лимфоцитов вызвано тем, что в этих клетках высокой активностью обладает дезоксигуанозинкиназа, а это приводит к накоплению дГТФ в концентрациях, которые, подобно дАТФ, ингибируют РНР.
У детей снижен клеточный иммунитет, хотя гуморальный иммунитет не страдает, так как в В-лимфоцитах дезоксигуанозинкиназа малоактивна и накопления дГТФ в токсических концентрациях не отмечают.
Болезнь, вызванная недостаточностью ПНФ, характеризуется более лёгким течением, чем болезнь, обусловленная дефицитом АДА.