БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 11. ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ ОБМЕНА ВЕЩЕСТВ И ФУНКЦИЙ ОРГАНИЗМА
III. Строение, биосинтез и биологическое действие гормонов
Гормоны образуются специализированными клетками, многие из них собраны в железы и секретируют гормоны непосредственно в кровоток (гипоталамус, гипофиз, островковые клетки поджелудочной железы, щитовидная и паращитовидные железы, надпочечники, половые железы). Многие эндокринные железы вырабатывают несколько гормонов, имеющих различное строение и осуществляющих различные функции.
Избыточная продукция или дефицит гормона могут быть причиной эндокринных заболеваний. Среди причин гиперсекреции гормонов первое место занимают гормонально-активные опухоли. Причинами гипосекреции часто являются генетические нарушения структуры и функции участвующих в синтезе гормонов ферментов, повреждение клеток, продуцирующих гормон, в результате инфекции, опухоли или аутоиммунных реакций. Клиническую картину гипер- и гипосекреции гормонов может вызывать и применение гормонов с лечебной целью. В некоторых случаях введение гормона приводит к подавлению его секреции железами, поэтому резкая отмена гормонотерапии вызывает гипофункцию эндокринных желёз.
Причинами эндокринных заболеваний могут также быть дефекты структуры самих гормонов или их рецепторов, нарушения метаболизма гормонов и механизмов передачи гормональных сигналов в клетки-мишени.
А. Гормоны гипоталамуса
Гипоталамус занимает важнейшее место в иерархической системе, объединяя высшие отделы ЦНС и эндокринные железы. В клетках нейронов гипоталамуса синтезируются пептидные гормоны 2 типов. Одни через систему гипоталамо-гипофизарных сосудов поступают в переднюю долю гипофиза, где стимулируют или ингибируют синтез тропных гормонов; другие, как окситоцин и вазопрессин, поступают через аксоны нервных клеток в заднюю долю гипофиза, где они хранятся в везикулах и секретируются в кровь в ответ на соответствующие сигналы.
В настоящее время известно несколько гипоталамических гормонов, регулирующих синтез и секрецию гормонов гипофиза (табл. 11-5).
Таблица 11-5. Строение и функции гормонов гипоталамуса
Гипоталамический гормон |
Структура |
Функция |
Тиреотропин-рилизинг-гормон (тиреолиберин, ТРФ) |
Пептид, 3 а.к.1 |
Стимулирует секрецию тиреотропина и пролактина |
Кортикотропин-рилизинг-гормон (кортиколиберин, КРФ) |
Полипептид, 41 а. к. |
Стимулирует секрецию кортикотропина |
Гонадотропин-рилизинг-гормон (гонадолиберин, ГРФ) |
Полипептид, 10 а. к. |
Стимулирует секрецию ЛГ и ФСГ |
Соматотропин-рилизинг-гормон (соматолиберин, СРФ) |
Полипептид, 40 или 44 а. к. |
Стимулирует секрецию соматотропина |
Соматостатин (соматотропин-ингибирующий гормон) |
Полипептид, 14 или 28 а. к. |
Ингибирует секрецию соматотропина |
Пролактолиберин2 |
Стимулирует секрецию пролактина |
|
Пролактостатин (дофамин)3 |
Полипептид, 56 а. к. |
Ингибирует секрецию пролактина |
1 а. к. — аминокислотный остаток.
2 Структура пролактолиберина в настоящее время неизвестна; подобными эффектами обладают также тиреолиберин, серотонин, окситоцин, ацетилхолин.
3 Другим гипоталамическим фактором, подавляющим синтез пролактина, является дофамин, который тормозит транскрипцию гена пролактина. Один из нейропептидов гипоталамуса, состоящий из 56 аминокислотных остатков, обладает как активностью гонадолиберина, так и пролактостатина. Его называют гонадолиберинассоциированным пептидом (ГАП, GAP).
1. Тиреолиберин — трипептид, состоящий из пироглутаминовой кислоты, гистидина и про- линамида (рис. 11-9).
Рис. 11-9. Структура некоторых гормонов гипоталамуса. А. Структура тиреолиберина: а — пироглутаминовая кислота; б — гистидин; в — пролинамид. Б. Структура соматостатина.

Синтез тиреолиберина происходит в различных участках гипоталамуса, но в большей сте
пени в паравентрикулярном ядре, а также в других областях ЦНС, где он выполняет функцию нейромедиатора, повышающего двигательную активность и АД. Предшественник тиреолиберина препротиреолиберин человека включает 242 аминокислотных остатка. Образование активного гормона происходит по механизму частичного протеолиза. В передней доле гипофиза тиреолиберин стимулирует синтез и секрецию тиреотропина, а также оказывает стимулирующее влияние на синтез многих других гормонов. В результате взаимодействия тиреолиберина с рецепторами плазматической мембраны клеток гипофиза происходит повышение концентрации внутриклеточного цАМФ и Са2+. Трансдукция сигнала происходит как через аде- нилатциклазную, так и через инозитолфосфатную системы.
Тиреолиберин разрушается в клетках-мишенях и в крови под действием специфических протеаз. Т1/2 в крови составляет 3 — 4 мин.
2. Кортиколиберин
Кортиколиберин — полипептид, содержащий 41 аминокислотный остаток. Как и другие пептидные гормоны, кортиколиберин синтезируется в виде прогормона. Т1/2кортиколиберина в плазме крови составляет 60 мин. Основное количество кортиколиберина образуется в гипоталамусе, однако он обнаруживается и в других отделах ЦНС, где выполняет роль медиатора, участвуя в ответной реакции на различные стрессовые ситуации.
В передней доле гипофиза кортиколиберин увеличивает синтез и секрецию проопиомеланокортина и образование кортикотропина. Рецепторы кортиколиберина находятся в плазматической мембране клеток в составе аденилатциклазного комплекса. Стимуляция секреции АКТГ требует присутствия ионов Са2+. Увеличение уровня внутриклеточного кальция, вероятно, является результатом фосфорилирования белков кальциевых каналов.
3. Гонадолиберин
Гонадолиберин — декапептид. Предшественник гонадолиберина человека состоит из 92 аминокислотных остатков и имеет молекулярную массу около 10 кД. Гонадолиберин стимулирует синтез и секрецию 2 гормонов гипофиза — ЛГ и ФСГ. Помимо гипоталамуса, нейроны, содержащие гонадолиберин, находятся и в других областях ЦНС, контролирующих эмоциональное и половое поведение. Рецептор гонадолиберина в плазматической мембране входит в состав инозитолфосфатного комплекса, активация которого стимулирует фосфорилирование белков и мобилизацию Са2+, что приводит к освобождению гормонов. Т1/2 гонадолиберина в плазме крови составляет 5 — 7 мин. Инактивация гонадолиберина происходит при участии специфических протеаз.
4. Соматолиберин
Соматолиберин — полипептид, состоящий из 44 аминокислотных остатков. В передней доле гипофиза соматолиберин стимулирует синтез и секрецию соматотропина. Трансдукция сигнала сопровождается повышением концентрации как цАМФ, так и ионов кальция. Т1/2 соматолиберина в крови составляет около 7 мин. Соматолиберин применяют в клинической практике для диагностики нарушений функции гипофиза.
5. Соматостатин
Соматостатин первично был выделен из гипоталамуса, но впоследствии оказалось, что он синтезируется во многих клетках, расположенных вне гипоталамуса: в желудке, кишечнике, поджелудочной железе, в области периферических нервных окончаний, в плаценте, надпочечниках и в сетчатке глаза. Соматостатин выполняет функции гормона и медиатора, вызывая торможение секреторных процессов, снижение активности гладкой мускулатуры и нейронов. Соматостатин состоит из 14 аминокислотных остатков и имеет циклическую структуру, образованную дисульфидной связью между двумя остатками цистеина (рис. 11-10).
Рис. 11-10. Гормон роста человека. Полипептидная цепь включает 191 аминокислотный остаток. Две дисульфидные связи образованы между остатками цистеина в положениях 183-189 и 53-165.

Биологической активностью обладает и ациклическая восстановленная форма пептида. В тканях соматостатин присутствует в форме пептида, содержащего 28 аминокислотных остатков и может служить предшественником пептида, состоящего из 14 аминокислотных остатков. Обе формы проявляют биологическую активность, но в разной степени. Соматостатин-14 находится в основном в ЦНС, а соматостатин-28 преимущественно в кишечнике.
Подобно другим пептидным гормонам, соматостатин взаимодействует с рецепторами плазматической мембраны клеток. Различают 5 типов рецепторов соматостатина, ассоциированных с G- белками. Все типы рецепторов экспрессируются в передней доле гипофиза и гипоталамусе и обладают различной степенью сродства к разным структурным формам соматостатина. Рецепторы к соматостатину присутствуют во многих опухолевых клетках, секретирующих гормоны. Это обстоятельство используется для разработки методов ранней диагностики опухолей поджелудочной железы, феохромоцитомы, рака щитовидной железы, рака почек и молочной железы.
Результат трансдукции сигнала соматостатина — снижение уровня внутриклеточной концентрации цАМФ и Са2+ в цитозоле клеток. Соматостатин тормозит секрецию гормона роста, глюкагона, инсулина, гастрина, секретина, вазоактивного интестинального пептида (ВИП, VIP), холецистокинина, кальцитонина, парат- гормона, иммуноглобулинов, ренина; он также ингибирует секрецию бикарбонатов и ферментов поджелудочной железы, уменьшает кровоток на всём протяжении ЖКТ, снижает секрецию жёлчи.
Б. Гормоны гипофиза
Гипофиз секретирует большое количество гормонов, участвующих в регуляции различных биохимических процессов и физиологических функций. В передней доле гипофиза (аденогипофизе) синтезируются так называемые тропные гормоны, стимулирующие синтез и секрецию гормонов других эндокринных желёз или оказывающие влияние на метаболические реакции в других тканях-мишенях (табл. 11-6).
Таблица 11-6. Строение и биологические функции гормонов передней доли гипофиза
Гормон |
Строение |
Биологическая функция |
Гормон роста (ГР), |
Полипептид, |
Стимулирует постнатальный рост скелета и мягких тканей. |
соматотропный гормон (СТГ) |
191 а. к |
Участвует в регуляции энергетического и минерального обмена. |
Тиреотропин |
Димер (αβ) |
Стимулирует синтез йодтиронинов |
Тиреотропный гормон (ТТГ) |
α-полипептид, 96 а. к. |
|
β-Полипептид, 112 а. к. |
||
Пролактин (ПРЛ) |
Полипептид, 197 а. к. |
Стимулирует лактацию |
Лютеинизирующий гормон (ЛГ) |
α-Полипептид, 96 а. к. |
У женщин индуцирует овуляцию У мужчин индуцирует синтез андрогенов в |
β-Полипептид, 121 а. к. |
клетках Лейдига |
|
Фолликулостимулирующий гормон (ФСГ) |
α-Полипептид, 96 а. к. |
У женщин стимулирует рост фолликулов У мужчин стимулирует сперматогенез |
β-Полипептид, 120 а. к. |
||
Кортикотропин, адренокортикотропный гормон (АКТГ) |
Полипептид, 39 а. к. |
Стимулирует рост надпочечников и синтез кортикостероидов |
β-Липотропин (Р-ЛТГ) |
Полипептид, 93 а. к. |
Стимулирует липолиз |
Задняя доля гипофиза, или нейрогипофиз, секретирует гормоны, регулирующие в основном водный баланс и лактацию.
Секреция гормонов гипофиза обусловлена сочетанием нервных и гуморальных сигналов. При этом один и тот же агонист (например, норадреналин) может вызывать противоположные изменения в секреции гипофизарных гормонов. С другой стороны, секреция каждого гормона может контролироваться многочисленными факторами.
Синтез и секреция гормонов передней доли гипофиза регулируются гормонами гипоталамуса, которые поступают в гипофиз через портальную систему кровеносных сосудов, связывающих гипоталамус и переднюю долю гипофиза. Кроме того, секреция гормонов гипоталамуса и гипофиза регулируется по механизму обратной связи гормонами, продукцию которых они стимулируют в органах-мишенях.
В передней доле гипофиза синтезируются гормоны, которые по химическому строению являются пептидами и гликопротеинами.
По механизму их синтеза и биологическим функциям эти гормоны объединяют в 3 группы.
1. Гормон роста, пролактин
Гормон роста синтезируется в соматотроф- ных клетках, наиболее многочисленных в передней доле гипофиза. Содержание гормона роста составляет 5 — 16 мг в 1 г ткани железы, в то время как количество других гормонов гипофиза исчисляется в мкг/г. Т1/2 гормона в плазме крови составляет около 50 мин.
Гормон роста у всех видов млекопитающих представляет собой одноцепочечный пептид с молекулярной массой 22 кД, состоящий из 191 аминокислотного остатка и имеющий 2 внутримолекулярные дисульфидные связи (рис. 11-10).
Гормон роста образуется из прогормона с молекулярной массой 28 кД, не обладающего гормональной активностью. Уровень гормона роста в плазме крови не превышает 3 нг/мл. Секреция гормона роста носит пульсирующий характер с интервалами в 20 — 30 мин. Один из самых больших пиков отмечается вскоре после засыпания.
Под влиянием различных стимулов (стресс, физические упражнения, гипогликемия, голодание, белковая пища, аминокислота аргинин) даже у нерастущих взрослых людей уровень гормона роста в крови может возрастать до 30 — 100 нг/мл.
Регуляция синтеза и секреции гормона роста осуществляется множеством факторов. Основной стимулирующий эффект оказывает соматолиберин, основной тормозящий — гипоталамический соматостатин.
Рецепторы гормона роста находятся в плазматической мембране клеток печени, жировой ткани, яичках, жёлтом теле, скелетных мышцах, хрящевой ткани, мозге, лёгких, поджелудочной железе, кишечнике, сердце, почках, лимфоцитах. Рецептор гормона роста — белок с одним внутримембранным доменом и молекулярной массой 70 кД. Связывание рецептора с гормоном роста вызывает димеризацию 2 рецепторов, что приводит к активации связанных с рецептором Янус-киназ и фосфорилированию Янус-киназ и рецептора по остаткам тирозина. Активация рецептора гормона роста сопровождается повышением активности тирозинкиназ и фосфолипазы С с последующим повышением уровня ДАГ и ИФ3 и активацией протеин- киназы С (см. раздел 5).
Первичные эффекты гормона роста кратковременны и инсулиноподобны. Они проявляются в основном в отношении обмена жиров и углеводов. В жировой ткани усиливается потребление глюкозы и липогенез, вследствие чего происходит снижение концентрации глюкозы в крови. Однако в дальнейшем проявляются более медленные (в основном, противоположные инсулину) эффекты: усиливается липолиз в жировой ткани, увеличивается концентрация жирных кислот в крови, а в случае недостаточности инсулина увеличивается содержание кетоновых тел в крови. Энергия, образующаяся при повышенном распаде жиров, используется на анаболические процессы. В то же время использование глюкозы жировыми и мышечными клетками снижается, а в печени ускоряется глюконеогенез, следствием чего может быть гипергликемия, особенно при недостатке инсулина (рис. 11-11).
Рис. 11-11. Биологическое действие гормона роста.

Основное действие гормона роста направлено на регуляцию обмена белков и процессов, связанных с ростом и развитием организма. Под влиянием гормона роста усиливаются транспорт аминокислот в клетки мышц, синтез белка в костях, хрящах, мышцах, печени и других внутренних органах, увеличивается общее количество РНК, ДНК и общее число клеток.
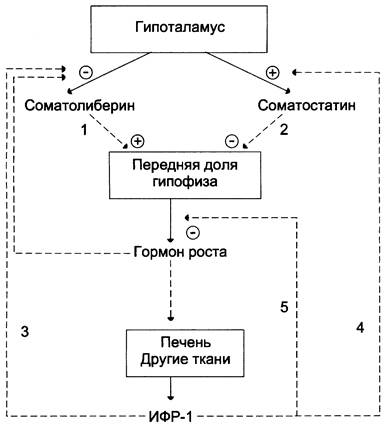
Влияние гормона роста на рост скелета и мягких тканей требует участия веществ, которые синтезируются в ответ на взаимодействие гормона роста с рецепторами плазматической мембраны клеток различных тканей, в основном печени, и носят название соматомединов. Поскольку эти молекулы отличаются высокой гомологичностью друг к другу, а также к проинсулину и обладают инсулиноподобной активностью и мощным ростстимулирующим действием, они называются инсулиноподобными факторами роста (ИФР-1, или соматомедин С; ИФР-2, или соматомедин А). ИФР-1 — одноцепочечный полипептид основного характера, содержащий 70 аминокислотных остатков, а полипептид ИФР-2 носит кислотный характер и состоит из 67 аминокислотных остатков. В крови примерно 95% соматомединов циркулирует в комплексе с белками. Синтез ИФР-1 в большей степени зависит от концентрации гормона роста в крови, чем синтез ИФР-2. В то же время ИФР-1, образующийся в печени, ингибирует синтез и секрецию гормона роста по механизму ретроингибирования, действуя на уровне гипофиза и гипоталамуса (рис. 11-12).
Рис. 11-12. Регуляция секреции гормона роста. Соматоли- берин стимулирует (1), а соматостатин ингибирует (2) освобождение гормона роста (ГР) из передней доли гипофиза. ИФР-1 ингибирует секрецию соматолиберина (3) и стимулирует секрецию соматостатина (4). ИФР-1 ингибирует секрецию гормона роста также на уровне гипофиза (5).
Инсулиноподобные факторы роста оказывают своё действие различными путями: эндокринным, паракринным и аутокринным (рис. 11-13).
Рис. 11-13. Действие гормона роста через ИФР. Гормон роста взаимодействует с рецептором плазматической мембраны клеток, стимулируя синтез ИФР (1). ИФР, в свою очередь, взаимодействуют со специфическими рецепторами клеток той же или других тканей (2) и стимулируют фосфорилирование белков, участвующих в митозе и росте (3).
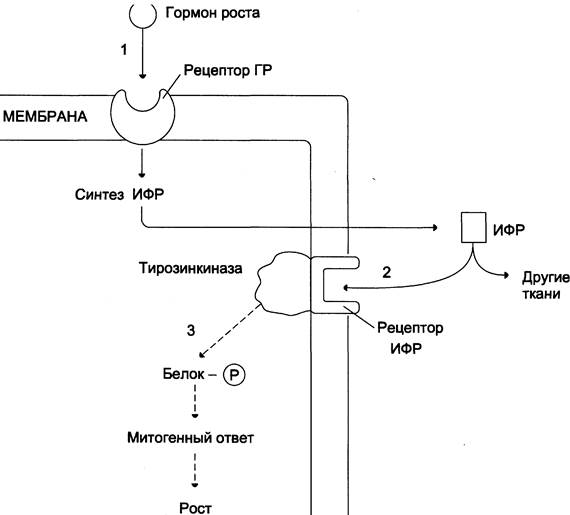
Подобно рецептору инсулина, рецептор ИФР-1 обладает тирозинкиназной активностью и инициирует каскад реакций фосфорилирования других белков, участвующих в различных внутриклеточных процессах, включая активацию транскрипции генов. В большинстве случаев ИФР-1, как и инсулин, инициирует клеточное развитие, однако при значительно меньших, почти физиологических концентрациях. Это указывает на то, что инсулиноподобные факторы роста более активны в отношении их действия на рост и развитие клеток.
Под влиянием гормона роста увеличивается ширина и толщина костей, и одновременно с этим ускоряется рост других тканей, включая соединительную ткань, мышцы и внутренние органы.
Пролактин синтезируется лактотрофными клетками передней доли гипофиза в виде прогормона с молекулярной массой 40 кД. Число этих клеток резко возрастает при беременности под влиянием эстрогенов. Пролактин близок по химическому строению гормону роста. Он состоит из 199 аминокислотных остатков, образующих одну полипептидную цепь с тремя дисульфидными связями. 35% аминокислотной последовательности пролактина идентично последовательностям гормона роста. Оба гормона имеют общие антигенные детерминанты, сходное строение рецепторов и пути трансдукции сигналов в клетки.
Рецепторы пролактина присутствуют в клетках многих тканей: в печени, почках, надпочечниках, яичках, яичниках, матке и других тканях.
Основная физиологическая функция пролактина — стимуляция лактации. Пролактин индуцирует синтез α-лактальбумина и казеина, активирует синтез фосфолипидов и ТАГ.
На процессы роста пролактин влияет в значительно меньшей степени, чем гормон роста.
У мужчин пролактин повышает чувствительность клеток Лейдига к лютеинизирующему гормону, поддерживая таким образом необходимый уровень синтеза тестостерона; в почках пролактин снижает экскрецию воды, влияет на реабсорбцию ионов Nа+ и К+; пролактин также повышает гуморальный и клеточный иммунитет.
Синтез и секрецию пролактина стимулируют тиреолиберин, серотонин, окситоцин, ацетилхолин, ингибирующий эффект оказывает дофамин.
Подобно большинству гормонов, пролактин секретируется в кровь эпизодически с интервалами 30 — 90 мин. Максимум секреции отмечается через 6 — 8 ч после начала сна. Концентрация пролактина в плазме крови женщин составляет 8 — 10 нг/мл, а мужчин — 5 — 8 нг/мл. Т1/2 пролактина составляет 15 — 20 мин.
Плацента продуцирует гормон (плацентарный лактоген), гомологичный по аминокислотному составу гормону роста и пролактину. Все 3 гормона имеют общие антигенные детерминанты и обладают рост-стимулирующей и лактогенной активностью. Существует гипотеза, согласно которой гены этих гормонов возникли в результате дупликации одного гена-предшественника.
2. Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
Тиреотропин, ЛГ и ФСГ — гликопротеины. Тиреотропин (ТТГ) с молекулярной массой около 30 кД синтезируется в тиреотрофных клетках передней доли гипофиза.
Стимуляция секреции тиреотропина происходит под влиянием тиреолиберина, а основное ингибирующее действие оказывает повышение уровня тиреоидных гормонов. Пик секреции ТТГ отмечается в часы, непосредственно предшествующие сну, с последующим снижением в течение ночи.
Основная биологическая функция тиреотропина — стимуляция синтеза и секреции йод- тиронинов (Т3 и Т4) в щитовидной железе. Трансдукция сигнала тиреотропина в клетки щитовидной железы происходит через рецепторы плазматической мембраны и активацию аденилатциклазы.
Рецептор тиреотропина состоит из 2 доменов, один из которых представляет собой гликопротеин, а второй — ганглиозид (гликолипид, содержащий сиаловую кислоту). Для проявления биологического действия необходимо связывание тиреотропина с обоими доменами рецептора.
Тиреотропин оказывает на щитовидную железу 2 типа эффектов. Одни проявляются быстро (в течение нескольких минут) и включают стимуляцию всех стадий синтеза и секреции йодтиронинов (см. ниже подраздел III, В). Проявление других требует нескольких дней. К ним относят стимуляцию синтеза белков, фосфолипидов, нуклеиновых кислот, увеличение размеров и количества тиреоидных клеток.
Некоторые иммуноглобулины класса G, взаимодействуя с рецепторами тиреотропина, имитируют эффекты гормона. Подобные иммуноглобулины обнаруживаются у большинства больных гипертиреозом (см. ниже подраздел III, В). Помимо стимулирующих, обнаруживаются и антитела, вызывающие разрушение клеток щитовидной железы. Образование антител, имитирующих эффекты тиреотропина, — одна из частых причин нарушений функций щитовидной железы.
В группу гормонов, относящихся к гликопротеинам, входят также гонадотропные гормоны гипофиза ЛГ и ФСГ и хорионический гонадотропин (ХГ) (рис. 11 -14).
Рис. 11-14. Строение гормонов передней доли гипофиза и хорионического гонадотропина. ТТГ, ФСГ, ЛГ и ХГ — гликопротеины, состоящие из 2 субъединиц; α-субъединицы всех 4 гормонов идентичны; β-субъединицы различаются первичной структурой, строением олигосахаридных фрагментов и участков гпикозипирования и определяют биологическую активность; α- и β-субъединицы содержат опигосахаридные фрагменты.

3. Группа гормонов, образующихся из проопиомеланокортина
Проопиомеланокортин (ПОМК) с молекулярной массой 28,5 кД синтезируется в передней и промежуточной долях гипофиза и в некоторых других тканях (кишечнике, плаценте). Полипептидная цепь ПОМК состоит из 265 аминокислотных остатков (рис. 11-15).
Рис. 11-15. Пептидные гормоны, образующиеся из ПОМК. А — ПОМК состоит из 265 аминокислотных остатков (а. к.), включая N-концевой сигнальный пептид из 26 аминокислот; Б — после отщепления сигнального пептида полипептидная цепь расщепляется на 2 фрагмента: АКТГ (39 а. к.) и β-липотропин (42-134 а. к); В, Г, Д — при дальнейшем протеолизе происходит образование α- и β-МСГ и эндорфинов. КППДГ — кортикотропиноподобный гормон промежуточной доли гипофиза.
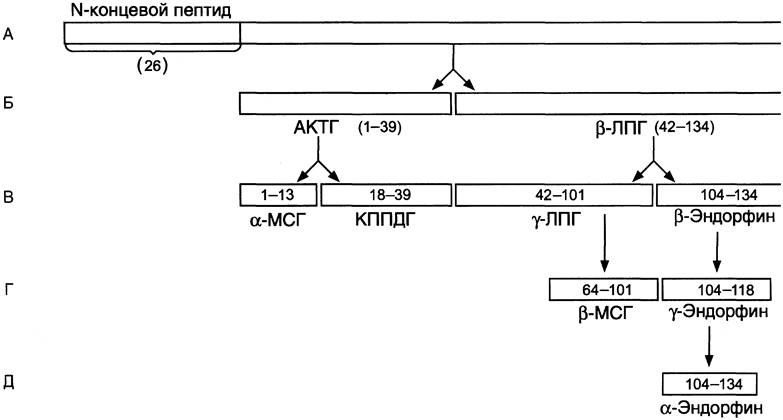
После отщепления сигнального пептида происходит частичный протеолиз оставшейся полипептидной цепи с образованием АКТГ и α-липотропина (β-ЛП). В разных клетках в результате избирательного протеолиза образуется разный набор пептидов: α- и β-меланоцитстимулирующих гормонов (α- и β-МСГ) и эндорфинов. β-МСГ и кортикотропиноподобный гормон промежуточной доли у человека практически не образуются, так как у взрослых людей промежуточная доля не развита. В гипофизе человека найдены p-липотропин, y-липотропин и β-эндорфин. Функции всех продуктов разрушения ПОМК недостаточно изучены.
Кортикотропин (АКТГ) — пептидный гормон; состоит из 39 аминокислотных остатков; синтезируется в клетках передней доли гипофиза под влиянием кортиколиберина.
Кортикотропин секретируется в импульсивном режиме. Скорость секреции составляет 5-25 мкг/сут. При стрессе (травма, ожог, хирургическое вмешательство, интоксикация химическими веществами, кровотечение, боль, психическая травма) концентрация АКТГ в крови возрастает во много раз. У здоровых людей наименьший уровень АКТГ в крови отмечается в конце дня и непосредственно перед сном, наибольший — в 6 — 8 ч утра, в момент пробуждения. Т1/2 в крови составляет 15 — 25 мин.
Механизм действия АКТГ включает взаимодействие с рецептором плазматической мембраны клеток, активацию аденилатциклазы и фосфорилирование белков, участвующих в синтезе кортикостероидов (см. ниже подраздел III, Д). Эти эффекты усиливаются в присутствии ионов Са2+. В клетках коры надпочечников АКТГ стимулирует гидролиз эфиров холестерола, увеличивает поступление в клетки холестерола в составе ЛПНП; стимулирует превращение холестерола в прегненолон; индуцирует синтез митохондриальных и микросомальных ферментов, участвующих в синтезе кортикостероидов. Подробнее этапы синтеза кортикостероидов рассматриваются в подразделе III, Д.
4. Гормоны задней доли гипофиза
Задняя доля гипофиза, или нейрогипофиз, секретирует 2 активных гормона — вазопрессин, или антидиуретический гормон (АДГ), и окситоцин. Окситоцин и вазопрессин — нонапептиды со сходной первичной структурой (рис. 11-16).
Рис. 11-16. Структура вазопрессина и окситоцина. Каждый нонапептид содержит остатки цистеина в положениях 1 и 6, связанные дисульфидными связями. У большинства животных и человека в положении 8 вазопрессина находится аргинин вместо лизина, в связи с чем он обозначается как аргинин вазопрессин.

Оба гормона образуются в гипоталамусе в нейронах разных гипоталамических ядер в форме прогормонов, из которых в результате посттрансляционной модификации образуются гормон г транспортный пептид нейрофизин (окситоцин- +нейрофизин I и вазопрессин+нейрофизин II) В процессе транспорта в клетки задней доли гипофиза гормоны остаются нековалентно связанными со своими транспортными пептидами В крови гормоны не связаны с нейрофизином Т1/2 составляет 2 — 4 мин.
Основные биологические эффекты вазопрессинг проявляются через взаимодействие с 2 типам* рецепторов. V1-рецепторы расположены в клетках гладкой мускулатуры сосудов в комплексе с фосфолипазой С. Результат трансдукци* сигнала в эти клетки — сокращение сосудов V2-рецепторы расположены в клетках почечны: канальцев. Взаимодействие вазопрессина с V2 рецепторами активирует аденилатциклазнук систему, увеличивая в клетках концентрации
цАМФ и активность протеинкиназы А. В результате этой активации происходит фосфорилирование белков, стимулирующих экспрессию генов белков, которые образуют каналы, обеспечивающие реабсорбцию воды (см. ниже подраздел VI, А).
Окситоцин стимулирует сокращение гладкой мускулатуры матки, а также играет важную роль в стимуляции лактации. Он вызывает сокращение миоэпителиальных клеток молочных желёз, в результате чего происходит перераспределение молока из альвеолярных протоков в область соска.
Акт сосания материнской груди стимулирует секрецию пролактина, обеспечивая образование и секрецию молока.
В. Нарушения функций гипоталамо-гипофизарной системы
Нарушения функций гипоталамо-гипофизарной системы характеризуются разнообразными клиническими проявлениями.
Гипофункция может быть следствием уменьшения или полного подавления продукции тропных гормонов (пангипопитуитаризм) или частичного, при котором происходит нарушение синтеза и секреции одного или нескольких гормонов. Недостаток тропных гормонов гипофиза ведёт к резкому снижению функции периферических эндокринных желёз.
Выпадение гонадотропной функции гипофиза приводит к недостаточности яичников, аменорее, атрофии матки, молочных желёз. Вследствие снижения продукции кортикотропина развивается хроническая недостаточность коры надпочечников.
Дефицит гормона роста особенно опасен у детей. Известно несколько типов нарушений способности к нормальному росту вследствие абсолютного или относительного дефицита СТГ.
Гипофизарный нанизм, или карликовость (от греч. nanos — карлик). Причина нарушения роста и физического развития — дефицит гормона роста. Большинство форм гипофизарного нанизма развивается вследствие мутаций гена гормона роста. У большинства больных гипофизарным нанизмом нарушение роста сочетается с другими эндокринными нарушениями. В некоторых случаях гипосекреция гормона роста может быть результатом аутоиммунного повреждения соматотрофных клеток гипофиза, черепно-мозговой травмы или радиации.
Нанизм Ларона возникает вследствие дефекта рецепторов гормона роста гепатоцитов и снижения синтеза ИФР-1 и ИФР-2. Концентрация СТГ в крови при этом повышена.
Карликовость африканских пигмеев — результат нарушения пострецепторной передачи гормонального сигнала СТГ. При этой форме карликовости концентрация гормона роста в плазме нормальная, а концентрация ИФР-1 значительно снижена.
Гиперфункция гормона роста обычно возникает в результате образования гормон-продуцирующей опухоли соматотрофных клеток гипофиза, что приводит к повышению ростовой активности. Если гиперсекреция гормона роста возникает у детей и подростков с незакончившимся процессом окостенения эпифизарных хрящей, но продолжающимся ростом длинных костей, развивается гигантизм (от греч. gigantos — великан). При гигантизме увеличение костей, мягких тканей и органов про-
исходит сравнительно пропорционально. Гиперсекреция гормона роста у взрослых людей приводит к развитию акромегалии (от греч. akros — крайний, megas — большой), при которой рост тела ускоряется, но не в длину, а в ширину с диспропорциональным увеличением размеров лица, кистей рук, стоп, черепа, увеличением размеров внутренних органов.
У многих (-40%) больных акромегалией обнаруживается мутация в α-субъединице G-белка плазматической мембраны соматотрофных клеток, в результате которой α-субъединица теряет ГТФ-азную активность. Вследствие этого развиваются продолжительная активация адени- латциклазы, избыточное образование цАМФ и избыточная секреция соматотропного гормона.
Г. Гормоны щитовидной железы
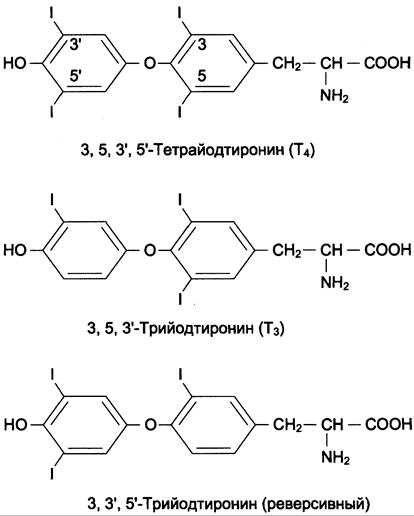
В щитовидной железе синтезируются гормоны — йодированные производные тирозина. Они объединены общим названием йодтирони- ны. К ним относят 3,5,3'-трийодтиронин (три- йодтиронин, Т3) и 3,5,3',5'-тетрайодтиронин (Т4), или тироксин (рис. 11-17).
Рис. 11-17. Структура гормонов щитовидной железы.
Йодгиронины участвуют в регуляции многих процессов метаболизма, развития, клеточной дифференцировки, в регуляции экспрессии генов.
Заболевания, возникающие в результате нарушений синтеза, секреции и функций йодтиронинов, — наиболее распространённые заболевания эндокринной системы.
1. Биосинтез йодтиронинов
Йодгиронины синтезируются в составе белка тиреоглобулина (Тг) (рис. 11-18) в фолликулах, которые представляют собой морфологическую и функциональную единицу щитовидной железы.
Тиреоглобулин — гликопротеин с молекулярной массой 660 кД, содержащий 115 остатков тирозина. 8 — 10% массы тиреоглобулина представлено углеводами. Содержание йодида в организме составляет 0,2 — 1%.
Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, затем переносится в цистерны ЭР, где происходит формирование вторичной и третичной структуры, включая процессы гликозилирования. Из цистерн ЭР тиреоглобулин поступает в аппарат Гольджи, включается в состав секреторных гранул и секретируется во внеклеточный коллоид, где происходит йодирование остатков тирозина и образование йодтиронинов.
Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов (рис. 11-18).
Рис. 11-18. Схема синтеза йодтиронинов. Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР — эндоплазматический ретикулум; ДИТ — дийодтиронин; Тг — тиреоглобулин; Т3 — трийодтиронин, Т4 — тироксин.
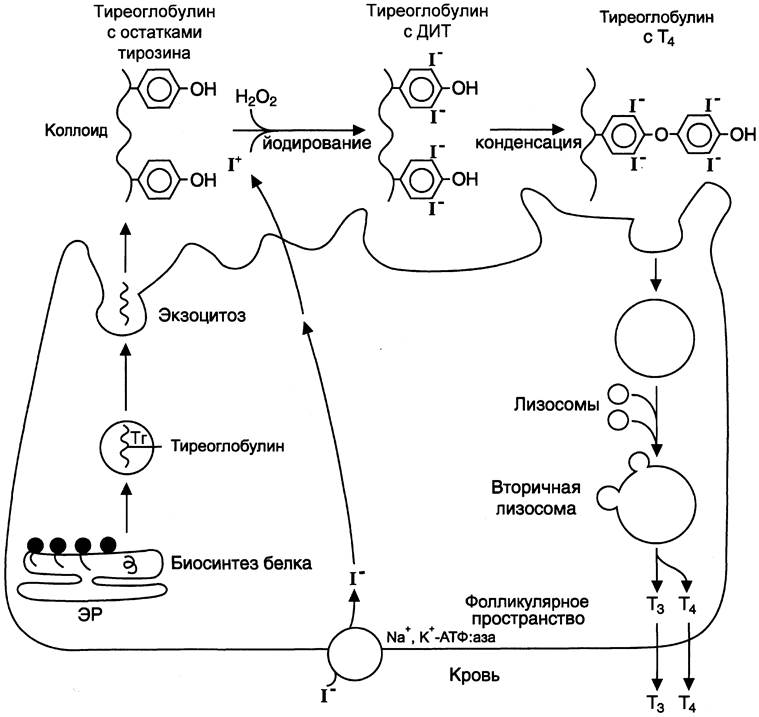
Транспорт йода в клетки щитовидной железы. Йод в виде органических и неорганических соединений поступает в ЖКТ с пищей и питьевой водой. Суточная потребность в йоде составляет 150-200 мкг. 25-30% этого количества йодидов захватывается щитовидной железой. Транспорт йодида в клетки щитовидной железы — энергозависимый процесс и происходит при участии специального транспортного белка против электрохимического градиента (соотношение концентраций I- в железе к концентрации I- в сыворотке крови в норме составляет 25:1). Работа этого йодид-переносящего белка сопряжена с Nа+, К+-АТФ-азой.
Окисление йода. Окисление I- в I+ происходит при участии гемсодержащей тиреопероксидазы и Н2O2 в качестве окислителя.
Йодирование тирозина. Окисленный йод взаимодействует с остатками тирозина в молекуле тиреоглобулина. Эта реакция также катализируется тиреопероксидазой.
Образование йодтиронинов. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием монойод- тирозинов (МИТ) и дийодтирозинов (ДИТ). Две молекулы ДИТ конденсируются с образованием йодтиронина Т4, а МИТ и ДИТ — с образованием йодтиронина Т3. Йодтиреоглобулин транспортируется из коллоида в фолликулярную клетку путём эндоцитоза и гидролизуется ферментами лизосом с освобождением Т3 и Т4. В нормальных условиях щитовидная железа секретирует 80 — 100 мкг Т4 и 5 мкг Т3 в сутки. Ещё 22 — 25 мкг Т3 образуется в результате дейодирования Т4 в периферических тканях по 5'-углеродному атому.
Транспорт и метаболизм йодтиронинов. От половины до двух третей Т3 и Т4 находятся в организме вне щитовидной железы. Большая часть их циркулирует в крови в связанной форме в комплексе с белками: тироксинсвязывающим глобулином (ТСГ) и тироксинсвязывающим преальбумином (ТСПА). ТСГ служит основным транспортным белком йодтиронинов, а также формой их депонирования. Он обладает более высоким сродством к Т3 и Т4 и в нормальных условиях связывает почти всё количество этих гормонов. Только 0,03% Т4 и 0,3% Т3 находятся в крови в свободной форме.
Т1/2 Т4 в плазме в 4-5 раз больше, чем Т3. Для Т4 этот период составляет около 7 дней, а для Т3 — 1 — 1,5 дня. Биологическая активность йодтиронинов обусловлена несвязанной фракцией. Т3 — основная биологически активная форма йодтиронинов; его сродство к рецептору клеток-мишеней в 10 раз выше, чем у Т4. В периферических тканях в результате дейодирования части Т4 по пятому углеродному атому образуется так называемая «реверсивная» форма Т3, которая почти полностью лишена биологической активности.
Другие пути метаболизма йодтиронинов включают полное дейодирование, дезаминирование или декарбоксилирование. Йодированные продукты катаболизма йодтиронинов конъюгируются в печени с глюкуроновой или серной кислотами (см. раздел 12), секретируются с жёлчью, в кишечнике вновь всасываются, дейодируются в почках и выделяются с мочой.
2. Регуляция синтеза и секреции йодтиронинов
Скорость синтеза и секреции йодтиронинов регулируются гипоталамо-гипофизарной системой по механизму обратной связи (рис. 11-19).
Рис. 11-19. Регуляция синтеза и секреции йодтиронинов. 1 — тиреолиберин стимулирует освобождение ТТГ; 2 — ТТГ стимулирует синтез и секрецию йодтиронинов; 3, 4 — йодтиронины тормозят синтез и секрецию ТТГ и тиреолиберина.

Стимулом для повышения секреции тиреолиберина и тиреотропина служит снижение концентрации йодтиронинов в крови.
3. Механизм действия и биологические функции йодтиронинов
Клетки-мишени йодтиронинов имеют 2 типа рецепторов к этим гормонам. Основные эффекты йодтиронинов — результат их взаимодействия с высокоспецифичными рецепторами, которые в комплексе с гормонами постоянно находятся в ядре и взаимодействуют с определёнными последовательностями ДНК, участвуя в регуляции экспрессии генов.
Другие рецепторы расположены в плазматической мембране клеток, но это не те же самые белки, что в ядре. Они обладают более низким сродством к йодтиронинам и, вероятно, обеспечивают связывание гормонов для удержания их в непосредственной близости к клетке.
При физиологической концентрации йодтиронинов их действие проявляется в ускорении белкового синтеза, стимуляции процессов роста и клеточной дифференцировки. В этом отношении йодтиронины — синергисты гормона роста. Кроме того, Т3 ускоряет транскрипцию гена гормона роста. У животных при дефиците Т3 клетки гипофиза теряют способность к синтезу гормона роста.
Очень высокие концентрации Т3 тормозят синтез белков и стимулируют катаболические процессы, показателем чего служит отрицательный азотистый баланс.
Метаболические эффекты йодтиронинов относят в основном к энергетическому метаболизму, что проявляется в повышении поглощения клетками кислорода. Этот эффект проявляется во всех органах, кроме мозга, РЭС и гонад.
В разных клетках Т3 стимулирует работу Na+, K+-ATФ-азы, на что затрачивается значительная часть энергии, утилизируемой клеткой.
В печени йодтиронины ускоряют гликолиз, синтез холестерола и синтез жёлчных кислот. В печени и жировой ткани Т3 повышает чувствительность клеток к действию адреналина и косвенно стимулирует липолиз в жировой ткани и мобилизацию гликогена в печени. В физиологических концентрациях Т3 увеличивает в мышцах потребление глюкозы, стимулирует синтез белков и увеличение мышечной массы, повышает чувствительность мышечных клеток к действию адреналина.
Йодтиронины также участвуют в формировании ответной реакции на охлаждение увеличением теплопродукции, повышая чувствительность симпатической нервной системы к норадреналину и стимулируя секрецию норадреналина (см. раздел 6).
4. Заболевания щитовидной железы
Гормоны щитовидной железы необходимы для нормального развития человека.
Гипотиреоз у новорождённых приводит к развитию кретинизма, который проявляется множественными врождёнными нарушениями и тяжёлой необратимой задержкой умственного развития.
Гипотиреоз развивается вследствие недостаточности йодтиронинов. Обычно гипотиреоз связан с недостаточностью функции щитовидной железы, но может возникать и при заболеваниях гипофиза и гипоталамуса.
Наиболее тяжёлые формы гипотиреоза, сопровождающиеся слизистым отёком кожи и подкожной клетчатки, обозначают термином «микседема» (от греч. myxa — слизь, oedema— отёк). Отёчность обусловлена избыточным накоплением гликозаминогликанов и воды. В подкожной клетчатке накапливается глюкуроновая и в меньшей степени хондроитинсерная кислоты. Избыток гликозаминогликанов вызывает изменения коллоидной структуры межклеточного матрикса, усиливает его гидрофильность и связывает ионы натрия, что приводит к задержке воды.
Характерные проявления заболевания: снижение частоты сердечных сокращений, вялость, сонливость, непереносимость холода, сухость кожи. Эти симптомы развиваются вследствие снижения основного обмена, скорости гликолиза, мобилизации гликогена и жиров, потребления глюкозы мышцами, уменьшения мышечной массы и снижения теплопродукции. При возникновении гипотиреоза у детей старшего возраста наблюдают отставание в росте без задержки умственного развития.
В настоящее время у взрослых людей частой причиной гипотиреоза является хронический аутоиммунный тиреоидит, приводящий к нарушению синтеза йодтиронинов (зоб Хашимото).
Гипотиреоз может быть также результатом недостаточного поступления йода в организм — эндемический зоб. Эндемический зоб (нетоксический зоб) часто встречается у людей, живущих в районах, где содержание йода в воде и почве недостаточно. Если поступление йода в организм снижается (ниже 100 мкг/сут), то уменьшается продукция йодтиронинов, что приводит к усилению секреции ТТГ (из-за ослабления действия йодтиронинов на гипофиз по механизму отрицательной обратной связи), под влиянием которого происходит компенсаторное увеличение размеров щитовидной железы (гиперплазия), но продукция йодтиронинов при этом не увеличивается.
Гипертиреоз возникает вследствие повышенной продукции йодтиронинов. Диффузный токсический зоб (базедова болезнь, болезнь Грейвса) — наиболее распространённое заболевание щитовидной железы. При этом заболевании отмечают увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов в 2 — 5 раз и развитие тиреотоксикоза.
Характерные признаки тиреотоксикоза: увеличение основного обмена, учащение сердцебиений, мышечная слабость, снижение массы тела (несмотря на повышенный аппетит), потливость, повышение температуры тела, тремор и экзофтальм (пучеглазие). Эти симптомы отражают одновременную стимуляцию йодтиронинами как анаболических (рост и дифференцировка тканей), так и катаболических (катаболизм углеводов, липидов и белков) процессов. В большей мере усиливаются процессы катаболизма, о чём свидетельствует отрицательный азотистый баланс.
Гипертиреоз может возникать в результате различных причин: развитие опухоли, тиреоидит, избыточное поступление йода и йодсодержащих препаратов, аутоиммунные реакции.
Болезнь Грейвса возникает в результате образования антител к тиреоидным антигенам. Один из них, иммуноглобулин (IgG), имитирует действие тиреотропина, взаимодействуя с рецепторами тиреотропина на мембране клеток щитовидной железы. Это приводит к диффузному разрастанию щитовидной железы и избыточной неконтролируемой продукции Т3 и Т4, поскольку образование IgG не регулируется по механизму обратной связи. Уровень ТТГ при этом заболевании снижен вследствие подавления функции гипофиза высокими концентрациями йодтиронинов.
Д. Гормоны коры надпочечников (кортикостероиды)
В коре надпочечников синтезируется более 40 различных стероидов, различающихся по структуре и биологической активности. Биологически активные кортикостероиды объединяют в 3 основные класса в зависимости от их преобладающего действия.
Глюкокортикоиды, С21-стероиды, играют важную роль в адаптации к стрессу. Они оказывают разнообразные эффекты, но наиболее важный — стимуляция глюконеогенеза (см. раздел 7). Основной глюкокортикоид человека — кортизол.
Минералокортикоиды, С21-стероиды, необходимы для поддержания уровня Na+ и К+. Самый активный гормон этого класса — альдостерон (см. ниже подраздел VI).
Андрогены — С19-стероиды. В коре надпочечников образуются предшественники андрогенов, из которых наиболее активный — дегидроэпиандростерон (ДЭА) и слабый — андростендион. Самый мощный андроген надпочечников тестостерон синтезируется в надпочечниках в небольшом количестве. Эти стероиды превращаются в более активные андрогены вне надпочечников. Тестостерон в незначительных количествах может превращаться в надпочечниках в эстрадиол. Но в норме продукция этих гормонов надпочечниками не играет существенной роли.
1. Биосинтез и метаболизм кортикостероидов
Общим предшественником кортикостероидов служит холестерол (рис. 11-20).
Рис. 11-20. Строение и основные этапы синтеза кортикостероидов. 1 — превращение холестерола в прегненолон (гидроксилаза, отщепляющая боковую цепь); 2 — образование прогестерона (3-β-гидроксистероиддегидрогеназа); 3, 4, 5 — реакции синтеза кортизола (3 — 17-гидроксилаза, 4 — 21-гидроксилаза, 5 — 11-гидроксилаза); 6, 7, 8 — путь синтеза альдостерона (6 — 21-гидроксилаза, 7 — 11-гидроксилаза, 8 — 18-гидроксилаза, 18-гидроксидегидрогеназа); 9,10,11 — путь синтеза тестостерона (9 — 17-гидроксилаза, 10 — 17,20-лиаза, 11 — дегидрогеназа).

В митохондриях холестерол превращается в прегненолон при участии гидроксилазы, относящейся к группе цитохромов Р450. Цитохром Р450, отщепляющий боковую цепь, локализован во внутренней мембране митохондрий. Отщепление боковой цепи холестерола включает 2 реакции гидроксилирования: одна — по атому С22, другая — по С20. Последующее отщепление шестиуглеродного фрагмента приводит к образованию С21-стероида — прегненолона. Дальнейшее превращение прегненолона происходит под действием различных гидроксилаз с участием молекулярного кислорода и NADPH, а также дегидрогеназ, изомераз и лиаз. Эти ферменты имеют различную внутри- и межклеточную локализацию. В коре надпочечников различают 3 типа клеток, образующих 3 слоя, или зоны: клубочковую, пучковую и сетчатую. Каким именно стероидом окажется конечный продукт, зависит от набора ферментов в клетке и последовательности реакций гидроксилирования. Например, ферменты, необходимые для синтеза альдостерона, присутствуют только в клетках клубочковой зоны, а ферменты синтеза глюкокортикоидов и андрогенов локализованы в пучковой и сетчатой зонах.
Путь биосинтеза кортизола. Кортизол синтезируется из холестерола, который в основном поступает из крови в составе ЛПНП или синтезируется в клетках из ацетил-КоА. Значительная часть эфиров холестерола накапливается в цитозоле клеток в липидных каплях. Под влиянием АКТГ происходит активация специфической эстеразы, и свободный холестерол транспортируется в митохондрии (рис. 11-21).
Рис. 11-21. Внутриклеточная локализация синтеза кортизола. 1 — аденилатциклазный комплекс; 2 — холестеролэстераза; 3 — протеинкиназа А; 4 — холестеролдесмолаза отщепляет боковую цепь холестерола. ХС — холестерол; ЭХС — эфиры холестерола.

Синтез кортизола начинается с превращения прегненолона в прогестерон. Эта реакция протекает в цитозоле клеток пучковой зоны коры надпочечников, куда прегненолон транспортируется из митохондрий. Реакцию катализирует 3-β-гидроксистероидцегидрогеназа.
В мембранах ЭР при участии 17-α-гидроксилазы происходит гидроксилирование прогестерона по С17 с образованием 17-гидроксипрогестерона. Этот же фермент катализирует превращение прегненолона в 17-гидроксипрегненолон, от которого далее при участии 17,20-лиазы может отщепляться двухуглеродная боковая цепь с образованием С19-стероида — дегидроэпиандростерона. 17-гидроксипрогестерон служит предшественником кортизола, а дегидроэпиандростерон — предшественником андрогенов. Далее 17-ОН-прогестерон гидроксилируется 21-гидроксилазой (Р450-С21), локализованной в мембране ЭР, и превращается в 11-дезоксикортизол, который переносится во внутреннюю мембрану митохондрий, где гидроксилируется при участии цитохрома Р450-с11 с образованием кортизола.
Скорость синтеза и секреции кортизола стимулируются в ответ на стресс, травму, инфекцию, понижение концентрации глюкозы в крови. Повышение концентрации кортизола подавляет синтез кортиколиберина и АКТГ по механизму отрицательной обратной связи.
Синтез минералокортикоидов в клетках клубочковой зоны коры надпочечников также начинается с превращения холестерола в прегненолон, а затем в прогестерон. Прогестерон гидроксилируется вначале по С21 с образованием 11-дезоксикортикостерона. Следующее гидроксилирование происходит по С11, что приводит к образованию кортикостерона, обладающего слабовыраженной глюкокортикоидной и минералокортикоидной активностью.
В клетках клубочковой зоны 17-α-гидроксилаза отсутствует, но есть митохондриальная 18-гидроксилаза, при участии которой кортикостерон гидроксилируется, а затем дегидрируется с образованием альдегидной группы у С18.
Главным стимулом для синтеза альдостерона служит ангиотензин II (см. ниже подраздел V).
Транспорт кортикостероидов. Кортизол в плазме крови находится в комплексе с α-глобулином транскортином и в небольшом количестве в свободной форме. Синтез транскортина протекает в печени и стимулируется эстрогенами.
Т1/2 кортизола составляет 1,5 — 2 ч. Несвязанный, или свободный кортизол, составляет около 8% от общего количества гормона в плазме и является биологически активной фракцией.
Альдостерон не имеет специфического транспортного белка, но образует слабые связи с альбумином.
Катаболизм гормонов коры надпочечников происходит прежде всего в печени. Здесь протекают реакции гидроксилирования, окисления и восстановления гормонов. Продукты катаболизма кортикостероидов (кроме кортикостерона и альдостерона) выводятся с мочой в форме 17-кетостероидов, образующихся в результате отщепления боковой цепи. Эти продукты метаболизма выделяются преимущественно в виде конъюгатов с глюкуроновой и серной кислотами. 17-Окси- и 17-кетостероиды образуются также при катаболизме половых гормонов, которые имеют у С17 гидрокси- или кетогруппы. У мужчин 2/3 кетостероидов образуется за счёт кортикостероидов и 1/3 за счёт тестостерона (всего 12-17 мг/сут). У женщин 17-кетостероиды образуются преимущественно за счёт кортикостероидов (7 — 12 мг/сут). Определение 17-кетостероидов в моче позволяет оценить, как количество глюкокортикоидов, секретируемых корой надпочечников, так и функцию надпочечников.
2. Биологические функции кортикостероидов отличаются широким спектром влияний на процессы метаболизма и подробно рассматриваются в соответствующих разделах.
Важнейший фактор в механизме действия кортикостероидов — взаимодействие их со специфическими рецепторами, расположенными в цитозоле клетки или в ядре. Регуляция внутриклеточных процессов под влиянием кортикостероидных гормонов проявляется в изменении
количества белков, обычно ключевых ферментов метаболизма, путём регуляции транскрипции генов в клетках-мишенях.
Влияние глюкокортикоидов на промежуточный метаболизм связано с их способностью координированно воздействовать на разные ткани и разные процессы, как анаболические, так и катаболические.
Кортизол стимулирует образование глюкозы в печени, усиливая глюконеогенез и одновременно увеличивая скорость освобождения аминокислот — субстратов глюконеогенеза из периферических тканей. В печени кортизол индуцирует синтез ферментов катаболизма аминокислот (аланинаминотрансферазы, триптофанпирролазы и тирозинаминотрансферазы и ключевого фермента глюконеогенеза — фосфоенолпируваткарбоксикиназы). Кроме того, кортизол стимулирует синтез гликогена в печени и тормозит потребление глюкозы периферическими тканями. Это действие кортизола проявляется в основном при голодании и недостаточности инсулина (см. ниже подраздел V). У здоровых людей эти эффекты кортизола уравновешиваются инсулином.
Избыточное количество кортизола стимулирует липолиз в конечностях и липогенез в других частях тела (лицо и туловище). Кроме того, глюкокортикоиды усиливают липолитическое действие катехоламинов и гормона роста.
Влияние глюкокортикоидов на обмен белков и нуклеиновых кислот проявляется двояко: в печени кортизол в основном оказывает анаболический эффект (стимулирует синтез белков и нуклеиновых кислот). В мышцах, лимфоидной и жировой ткани, коже и костях кортизол тормозит синтез белков, РНК и ДНК и стимулирует распад РНК и белков.
При высокой концентрации глюкокортикоиды подавляют иммунные реакции, вызывая гибель лимфоцитов и инволюцию лимфоидной ткани; подавляют воспалительную реакцию, снижая число циркулирующих лейкоцитов, а также индуцируя синтез липокортинов, которые ингибируют фосфолипазу А2, снижая таким образом синтез медиаторов воспаления — простагландинов и лейкотриенов (см. раздел 8).
Высокая концентрация глюкокортикоидов вызывает торможение роста и деления фибробластов, а также синтез коллагена и фибронектина (см. раздел 15). Для гиперсекреции глюкокортикоидов типичны истончение кожи, плохое заживление ран, мышечная слабость и атрофия мышц.
Глюкокортикоиды участвуют в физиологическом ответе на стресс, связанный с травмой, инфекцией или хирургическим вмешательством. В этом ответе в первую очередь участвуют катехоламины, но во многих случаях для проявления их максимальной активности необходимо участие глюкокортикоидов.
Минералокортикоиды стимулируют реабсорбцию Nа+ в дистальных извитых канальцах и собирательных трубочках почек. Кроме того, они способствуют секреции К+, NH4+ в почках, а также в других эпителиальных тканях: потовых железах, слизистой оболочке кишечника и слюнных железах. В организме человека альдостерон — наиболее активный минералокортикоид.
Механизм действия и биологические эффекты альдостерона подробно рассмотрены в подразделе VI этого раздела.
3. Изменения метаболизма при гипо- и гиперфункции коры надпочечников
Заболевания коры надпочечников могут проявиться симптомами как гипо-, так и гиперпродукции гормонов.
Большинство клинических проявлений надпочечниковой недостаточности обусловлено дефицитом глюкокортикоидов и минералокортикоидов.
Острая надпочечниковая недостаточность представляет большую угрозу для жизни, так как сопровождается декомпенсацией всех видов обмена и процессов адаптации. Она проявляется сосудистым коллапсом, резкой адинамией, потерей сознания. Такое состояние возникает вследствие нарушения обмена электролитов, которое приводит к потере ионов Na+ и Сl- с мочой, обезвоживанию за счёт потери внеклеточной жидкости, повышению уровня К+ в сыворотке крови, в межклеточной жидкости и клетках, в результате чего может нарушаться сократительная способность миокарда. Изменение углеводного обмена проявляется в снижении уровня сахара в крови, уменьшении запаса гликогена в печени и скелетных мышцах.
Острая недостаточность функции коры надпочечников может быть следствием декомпенсации хронических заболеваний, а также развивается у больных, лечившихся длительное время глюкокортикоидными препаратами по поводу неэндокринных заболеваний, например, инфекционно-аллергических заболеваний.
В результате длительного приёма глюкокортикоидов подавляется функция гипоталамо- гипофизарно-надпочечниковой системы и развивается атрофия клеток коры надпочечников. Резкая отмена гормональных препаратов может сопровождаться острой надпочечниковой недостаточностью (так называемый синдром «отмены»).
Первичная недостаточность надпочечников (болезнь Аддисона) развивается в результате поражения коры надпочечников туберкулёзным или аутоиммунным процессом. Основные клинические проявления выражаются в снижении массы тела, общей слабости, снижении аппетита, тошноте, рвоте, снижении АД и типичной для первичной надпочечниковой недостаточности гиперпигментации кожи («бронзовая болезнь»). Причина гиперпигментации — повышение продукции ПОМК — предшественника АКТГ и меланоцитстимулирующего гормона.
Вторичная недостаточность надпочечников может развиться при дефиците АКТГ, что, в свою очередь, может быть следствием опухоли или инфекционного поражения гипофиза. При вторичной недостаточности надпочечников, в отличие от болезни Аддисона, отсутствует гиперпигментация.
При врождённой гиперплазии надпочечников нарушается синтез кортизола. В 95% случаев при этой патологии обнаруживается дефект 21-гидроксилазы (реже 11-гидроксилазы). Снижение продукции кортизола сопровождается увеличением секреции АКТГ, накоплением промежуточных продуктов синтеза кортикостероидов, в частности, предшественников андрогенов.
Избыток андрогенов ведёт к усилению роста тела, раннему половому созреванию у мальчиков и развитию мужских половых признаков у девочек (адреногенитальный синдром).
При частичной недостаточности 21-гидроксилазы у женщин может нарушаться менструальный цикл.
Гиперпродукция глюкокортикоидов (гиперкортицизм) может быть следствием повышения уровня АКТГ при опухолях гипофиза (болезнь Иденко—Кушинга) и опухолях других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола при гормонально-активных опухолях коры надпочечников (синдром Иценко—Кушинга).
При гиперкортицизме наблюдаются гипергликемия и снижение толерантности к глюкозе, обусловленные стимуляцией глюконеогенеза («стероидный диабет»), усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани. Характерно своеобразное перераспределение отложений жира («лунообразное лицо», выступающий живот). Гипернатриемия, гипертензия, гипокалиемия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.
Для выявления первичной причины гиперкортицизма, помимо определения концентрации АКТГ в плазме крови, используют тесты с применением высоких доз синтетического глюкокортикоида дексаметазона (структурного аналога кортизола). Дексаметазон подавляет секрецию АКТГ по механизму отрицательной обратной связи.
Для болезни Иценко-Кушинга характерно снижение концентрации кортизола после применения дексаметазона более чем на 50%. Отсутствие реакции на введение дексаметазона может указывать на наличие опухоли надпочечников или внегипофизарной секреции АКТГ.
Е. Гормоны мозгового слоя надпочечников
Подобно задней доле гипофиза, мозговой слой надпочечников — производное нервной ткани. Его можно рассматривать как продолжение симпатической нервной системы, так как преганглионарные волокна чревного нерва оканчиваются на хромаффинных клетках мозгового слоя надпочечников.
Своё название эти клетки получили потому, что они содержат гранулы, окрашивающиеся бихроматом калия в красный цвет. Такие клетки находятся также в сердце, печени, почках, половых железах, постганглионарных нейронах симпатической нервной системы и в ЦНС.
При стимуляции преганглионарного нейрона хромаффинные клетки продуцируют катехоламины — дофамин, адреналин и норадреналин.
У большинства видов животных хромаффинные клетки секретируют в основном адреналин (~ 80%) и в меньшей степени норадреналин.
По химическому строению катехоламины -3,4-дигидроксипроизводные фенилэтиламина. Непосредственным предшественником гормонов служит тирозин (см. раздел 9).
1. Синтез и секреция катехоламинов
Синтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников (рис. 11-22). В гранулах происходит также запасание катехоламинов.
Катехоламины поступают в гранулы путём АТФ-зависимого транспорта и хранятся в них в комплексе с АТФ в соотношении 4:1 (гормон- АТФ). Разные гранулы содержат разные катехоламины: некоторые только адреналин, другие — норадреналин, третьи — оба гормона.
Рис. 11-22. Синтез и секреция катехоламинов. Биосинтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников. В одних гранулах содержится адреналин, в других норадреналин, а в некоторых — оба гормона. При стимуляции содержимое гранул высвобождается во внеклеточную жидкость. А — адреналин; НА — норадреналин.

Секреция гормонов из гранул происходит путём экзоцитоза. Катехоламины и АТФ освобождаются из гранул в том же соотношении, в каком они сохраняются в гранулах. В отличие от симпатических нервов, клетки мозгового слоя надпочечников лишены механизма обратного захвата выделившихся катехоламинов.
В плазме крови катехоламины образуют непрочный комплекс с альбумином. Адреналин транспортируется в основном к печени и скелетным мышцам. Норадреналин образуется в основном в органах, иннервируемых симпатическими нервами (80% от общего количества). Норадреналин лишь в незначительных количествах достигает периферических тканей. Т1/2 катехоламинов — 10-30 с. Основная часть катехоламинов быстро метаболизируется в различных тканях при участии специфических ферментов (см. раздел 9). Лишь небольшая часть адреналина (~ 5%) выделяется с мочой.
2. Механизм действия и биологические функции катехоламинов
Катехоламины действуют на клетки-мишени через рецепторы, локализованные в плазматической мембране. Выделяют 2 главных класса таких рецепторов, α-адренергические и β-адренергические. Все рецепторы катехоламинов — гликопротеины, которые являются продуктами разных генов, различаются сродством к агонистам и антагонистам и передают сигналы в клетки с помощью разных вторичных посредников. Это определяет характер их влияния на метаболизм клеток-мишеней.
Адреналин взаимодействует как с α-, так и с β-рецепторами; норадреналин в физиологических концентрациях главным образом взаимодействует с α-рецепторами.
Взаимодействие гормона с β-рецепторами активирует аденилатциклазу, тогда как связывание с α2-рецептором её ингибирует. При взаимодействии гормона с α1-рецептором происходит активация фосфолипазы С и стимулируется инозитолфосфатный путь передачи сигнала (см. раздел 5).
Биологические эффекты адреналина и норадреналина затрагивают практически все функции организма и рассматриваются в соответствующих разделах. Общее во всех этих эффектах заключается в стимуляции процессов, необходимых для противостояния организма чрезвычайным ситуациям.
3. Патология мозгового вещества надпочечников
Основная патология мозгового вещества надпочечников — феохромоцитома, опухоль, образованная хромаффинными клетками и продуцирующая катехоламины. Клинически феохромоцитома проявляется повторяющимися приступами головной боли, сердцебиения, потливости, повышением АД и сопровождается характерными изменениями метаболизма (см. разделы 7, 8).
Ж. Гормоны поджелудочной железы и желудочно-кишечного тракта
Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную и эндокринную. Экзокринная функция обеспечивает синтез и секрецию ферментов и ионов, необходимых для процессов пищеварения. Эндокринную функцию выполняют клетки островкового аппарата поджелудочной железы, которые секретируют гормоны, участвующие в регуляции многих процессов в организме.
В островковой части поджелудочной железы (островки Лангерханса) выделяют 4 типа клеток, секретирующих разные гормоны: А- (или α-) клетки секретируют глюкагон, В- (или β-) — инсулин, D- (или δ-) — соматостатин, F-клетки секретируют панкреатический полипептид.
1. Инсулин. Строение, синтез и секреция
Инсулин — полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В — 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками (рис. 11-23). Инсулин может существовать в нескольких формах: мономера, димера и гексамера. Гексамерная структура инсулина стабилизируется ионами цинка, который связывается остатками Гис в положении 10 В-цепи всех 6 субъединиц.
Рис. 11-23. Структура инсулина человека. А. Первичная структура инсулина. Б. Модель третичной структуры инсулина (мономер): 1 — А-цепь; 2 — В-цепь; 3 — участок связывания с рецептором.
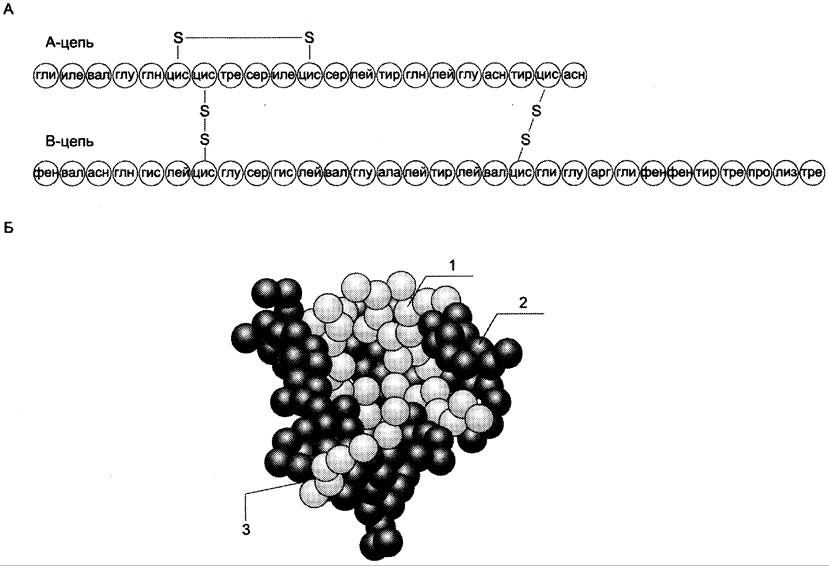
Молекула инсулина содержит также внутримолекулярный дисульфидный мостик, соединяющий шестой и одиннадцатый остатки в А- цепи. Инсулины некоторых животных имеют значительное сходство по первичной структуре с инсулином человека.
Бычий инсулин отличается от инсулина человека по трём аминокислотным остаткам, а инсулин свиньи отличается только на одну аминокислоту, которая представлена аланином вместо треонина на карбоксильном конце В-цепи.
В обеих цепях во многих положениях встречаются замены, не оказывающие влияния на биологическую активность гормона. Наиболее часто эти замены обнаруживаются в положениях 8, 9 и 10 цепи А.
В то же время в положениях дисульфидных связей, остатков гидрофобных аминокислот в С-концевых участках В-цепи и С- и N-концевых остатков А-цепи замены встречаются очень редко, что свидетельствует о важности этих участков для проявления биологической активности инсулина. Использование химических модификаций и замен аминокислот в этих участках позволили установить структуру активного центра инсулина, в формировании которого принимают участие остатки фенилаланина В-цепи в положениях 24 и 25 иN-и С-концевые остатки цепи А.
Биосинтез инсулина включает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате последовательного протеолиза превращаются в активный гормон. Биосинтез препроинсулина начинается с образования сигнального пептида на полирибосомах, связанных с ЭР. Сигнальный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи. После окончания синтеза препроинсулина сигнальный пептид, включающий 24 аминокислотных остатка, отщепляется (рис. 11-24).
Рис. 11-24. Схема биосинтеза инсулина в β-клетках островков Лангерханса. ЭР — эндоплазматический ретикулум. 1 — образование сигнального пептида; 2 — синтез препроинсулина; 3 — отщепление сигнального пептида; 4 — транспорт проинсулина в аппарат Гольджи; 5 — превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 — секреция инсулина и С-пептида.

Проинсулин (86 аминокислотных остатков) поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина (51 аминокислотный остаток) и С-пептида, состоящего из 31 аминокислотного остатка.
Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. Т1/2 инсулина в плазме крови составляет 3 — 10 мин, С-пептида — около 30 мин.
Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках.
Регуляция синтеза и секреции инсулина. Глюкоза — главный регулятор секреции инсулина, а β-клетки — наиболее важные глюкозо-чувствительные клетки в организме. Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Действие глюкозы на скорость экспрессии генов может быть прямым, когда глюкоза непосредственно взаимодействует с транскрипционными факторами, или вторичным, через влияние на секрецию инсулина и глюкагона. При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, что сопровождается активацией транскрипции мРНК инсулина.
Синтез и секреция инсулина не являются строго сопряжёнными процессами. Синтез гормона стимулируется глюкозой, а секреция его является Са2+-зависимым процессом и при дефиците Са2+ снижается даже в условиях высокой концентрации глюкозы, которая стимулирует синтез инсулина.
Потребление глюкозы β-клетками происходит в основном при участии ГЛЮТ-1 и ГЛЮТ-2, и концентрация глюкозы в клетках быстро уравнивается с концентрацией глюкозы в крови. В β-клетках глюкоза превращается в глюкозо- 6-фосфат глюкокиназой, имеющей высокую Кm, вследствие чего скорость её фосфорилирования почти линейно зависит от концентрации глюкозы в крови. Фермент глюкокиназа — один из важнейших компонентов глюкозо-чувствительного аппарата β-клеток, в который, помимо глюкозы, вероятно, входят промежуточные продукты метаболизма глюкозы, цитратного цикла и, возможно, АТФ. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета.
На секрецию инсулина влияют другие гормоны. Адреналин через α2-рецепторы тормозит секрецию инсулина даже на фоне стимуляции глюкозой, β-адренергические агонисты её стимулируют, вероятно, в результате повышения концентрации цАМФ. Этот механизм, полагают, лежит в основе действия гормонов ЖКТ, таких как секретин, холецистокинин и желудочный ингибирующий пептид (GIP), которые повышают секрецию инсулина. Высокие концентрации гормона роста, кортизола, эстрогенов также стимулируют секрецию инсулина.
2. Биологические функции инсулина
Инсулин — главный анаболический гормон. Он участвует в регуляции метаболизма, транспорта глюкозы, аминокислот, ионов, в синтезе белков. Инсулин влияет также на процессы репликации и транскрипции, участвуя таким образом в регуляции клеточной дифференцировки, пролиферации и трансформации клеток. Участие инсулина в регуляции метаболизма рассмотрено в соответствующих разделах (см. разделы 7, 8, 9). Влияние инсулина на ключевые ферменты метаболизма представлено в табл. 11-7.
Таблица 11-7. Влияние инсулина на ключевые ферменты метаболизма
Печень |
Мышцы |
Жировая ткань |
Активация |
||
1. Фосфодиэстераза |
1. Фосфодиэстераза |
1. ЛП-липаза |
2. Фосфофруктокиназа |
2. Фосфофруктокиназа |
2. Фосфофруктокиназа |
3. Пируваткиназа |
3. Пируваткиназа |
3. Пируваткиназа |
4. Пируватдегидрогеназный комплекс |
4. Пируватдегидрогеназный комплекс |
4. Ацетил-КоА-карбоксилаза |
5. Фосфатаза гликогенсинтазы и гликогенфосфорилазы |
5. Фосфатаза гликогенсинтазы |
|
6.Ацетил-КоА-карбоксилаза |
||
Индукция |
||
1. Глюкокиназа |
1. Глицеральдегидфосфат- дегидрогеназа |
|
2. Цитратлиаза |
||
3. Пальмитатсинтаза |
2. Пальмитатсинтаза |
|
4. Пируваткиназа |
||
5. Ацетил-КоА-карбоксилаза |
||
6. Глюкозо-6-фосфат-дегидрогеназа |
||
Репрессия |
||
Фосфоенолпируваткарбоксикиназа |
Транспорт глюкозы в клетки происходит при участии специальных белков-переносчиков (см. раздел 7). Переносчик, регулируемый инсулином (ГЛЮТ-4), содержится только в мышцах и жировой ткани (инсулинзависимые ткани). В отсутствие инсулина ГЛЮТ-4 находятся в цитозольных везикулах. Под влиянием инсулина происходит транслокация везикул в плазматическую мембрану; при снижении концентрации гормона глюкотранспортёры возвращаются в цитозоль, и транспорт глюкозы прекращается.
В клетках печени инсулин индуцирует синтез глюкокиназы. В результате фосфорилирования концентрация свободной глюкозы в клетках поддерживается на низком уровне, что способствует её транспорту из крови по градиенту концентрации.
Влияние инсулина на метаболизм глюкозы. Инсулин стимулирует утилизацию глюкозы в клетках разными путями. Около 50% глюкозы используется в процессе гликолиза, 30-40% превращается в жиры и около 10% накапливается в форме гликогена. Общий результат стимуляции этих процессов — снижение концентрации глюкозы в крови.
Влияние инсулина на метаболизм глюкозы осуществляется путём повышения активности и количества ключевых ферментов гликолиза: глюкокиназы, фосфофруктокиназы, пируват- киназы (см. раздел 7). В мышцах инсулин активирует гексокиназу II. В печени и мышцах под влиянием инсулина снижается концентрация цАМФ в результате активации фосфодиэстеразы. Кроме того, инсулин активирует фосфатазы, дефосфорилирующие гликогенсинтазу, в результате чего происходит активация синтеза гликогена и тормозится его распад.
Эффекты инсулина, обусловленные фосфорилированием и дефосфорилированием ферментов, проявляются очень быстро, в течение нескольких секунд и минут. Параллельно с активацией ферментов гликолиза инсулин тормозит глюконеогенез, репрессируя синтез ключевого фермента глюконеогенеза — фосфоенолпируваткарбоксикиназы (ФЕП карбоксикиназы).
Влияние инсулина на метаболизм жиров. В печени и жировой ткани инсулин стимулирует синтез жиров, обеспечивая получение для этого процесса необходимых субстратов (ацетил-КоА, α-глицерофосфат и NАDРН) из глюкозы. В адипоцитах инсулин активирует ацетил КоА-карбок- силазу и ЛП-липазу и индуцирует синтез синтазы жирных кислот, ацетил-КоА-карбоксилазы и ЛП-липазы (см. раздел 8 и табл. 11-7). Инсулин в жировой ткани тормозит мобилизацию жиров. Он активирует фосфатазу, которая дефосфорилирует и тем самым инактивирует гормончувствительную ТАГ-липазу. Таким образом, под влиянием инсулина снижается концентрация жирных кислот, циркулирующих в крови (см. раздел 8). Инсулин стимулирует потребление нейтральных аминокислот в мышцах и синтез белков в печени, мышцах и сердце.
Инсулин стимулирует пролиферацию большого количества клеток в культуре тканей, а также, вероятно, может участвовать в регуляции роста in vivo. Для изучения регуляции роста чаще всего используют культуры фибробластов. В таких клетках инсулин усиливает способность фактора роста фибробластов (FGF), тромбоцитарного фактора роста (PDGF), фактора роста эпидермиса (EGF), простагландина (PGF2α), вазопрессина и аналогов цАМФ активировать размножение клеток, остановленных в фазе G.
3. Механизм действия инсулина
Действие инсулина начинается с его связывания со специфическим гликопротеиновым рецептором на поверхности клетки-мишени (см. раздел 5). Рецепторы инсулина обнаружены почти во всех типах клеток, но больше всего их в гепатоцитах и клетках жировой ткани. Так как концентрация инсулина в крови составляет ~10-10 М, количество рецепторов, связанных с инсулином, зависит от их количества на мембране клетки. Клетки с разным содержанием рецепторов реагируют поразному на одну и ту же концентрацию гормона.
Инсулиновый рецептор (IR) постоянно синтезируется и разрушается. Т1/2 рецептора составляет 7 — 12 ч. При высокой концентрации инсулина в плазме крови, например, при ожирении, число инсулиновых рецепторов может уменьшаться, и клетки-мишени становятся менее чувствительными к инсулину, что может быть одной из причин сахарного диабета II типа (см. ниже подраздел V).
Снижение чувствительности клеток к гормону (десенситизация) опосредуется 2 механизмами. Первый включает утрату рецепторов путём их интернализации. Комплекс инсулин-рецептор захватывается внутрь клетки эндоцитозом. В результате интернализации часть рецепторов подвергается разрушению в лизосомах, а часть возвращается в плазматическую мембрану. Второй механизм десенситизации — ковалентная модификация рецептора в результате фосфорилирования. Так, фосфорилирование IR по остаткам серина и треонина снижает его сродство к инсулину.
Рецептор инсулина относят к типу рецепторов, обладающих тирозинкиназной активностью (см. раздел 5). Стимулированное инсулином аутофосфорилирование β-субъединицы IR по остаткам тирозина приводит к фосфорилированию других внутриклеточных белков — субстратов инсулинового рецептора (IRS). Известно несколько таких субстратов: IRS-1, IRS-2, а также некоторые белки семейства STAT.
Главную роль в формировании ответной реакции клетки на инсулиновый сигнал играет IRS-1. IRS-1 — фосфопротеин, состоящий из более чем 1200 аминокислотных остатков. Часть остатков серина, тирозина и треонина фосфорилирована. При стимуляции инсулином степень фосфорилирования IRS-1 увеличивается и придаёт ему способность соединяться с другими цитозольными белками. Это приводит к активации нескольких сигнальных путей, представляющих каскад реакций активации специфических протеинкиназ. В результате активации протеинкиназ происходит фосфорилирование ферментов и факторов транскрипции, что составляет основу многочисленных эффектов инсулина.
Активация инсулином сигнального пути Ras. Белок, известный как Ras-белок, относят к семейству малых ГТФ-связывающих белков. В неактивном состоянии Ras-белок прикреплён к внутренней поверхности плазматической мембраны и связан с ГДФ. Стимуляция инсулином приводит к образованию активной ГТФ-связанной формы Ras (рис. 11-25).
Рис. 11-25. Активация Ras-пути инсулином. 1 — GRB-2/mSOS — цитозольный белок нековалентно присоединяется к фосфорилированному рецептору инсулина при участии одного из субстратов инсулинововго рецептора — She; 2 — образовавшийся комплекс взаимодействует с белком Ras; в этот комплекс включаются также белки, которые обеспечивают отделение от Ras ГДФ и присоединение ГТФ; 3 — активированный Ras соединяется с протеинкиназой Raf-1, вследствие чего происходит активация Raf-1-киназы; 4, 5 — активированная Raf-1-киназа стимулирует каскад реакций фосфорилирования и активации других протеинкиназ, в частности, МАПКК и МАПК. МАПК фосфорилируют многие цитоплазматические белки и факторы транскрипции. МАПК — митогенактивируемые протеинкиназы.

Превращение Ras-белка в активную форму происходит при участии семейства белков, являющихся активаторами протеинкиназ и про- теинкиназами и, так же, как Ras-белок, получившие свои названия от онкогенов (см. раздел 16). Один из субстратов инсулинового рецептора She участвует в образовании комплекса с небольшим цитозольным белком Grb. Образовавшийся комплекс взаимодействует с Ras-белком. В этот комплекс включаются другие белки: GAP (от англ. GTP-ase activating factor — фактор, активирующий ГТФ: азу), GEF (от англ. GTP exchange factor — фактор обмена ГТФ) и SOS (от англ, son of sevenless, названный по мутации гена у мушки дрозофилы). Два последних белка способствуют отделению ГДФ от Ras-белка и присоединению ГТФ. Активированный Ras соединяется с протеинкиназой Raf-1. Raf-1 в неактивном состоянии находится в цитозоле в соединении с шаперонами. Активация Raf-1 происходит в результате многоэтапного процесса, включающего присоединение белка к плазматической мембране, фосфорилирование и взаимодействие с рецептором инсулина. Активированная Raf-киназа стимулирует каскад реакций фосфорилирования и активации других протеинкиназ, в частности, митогенактивируемых протеинкиназ (МАПК). При участии Raf-1 сначала фосфорилируется и активируется киназа МАПК, которая, в свою очередь, фосфорилирует МАПК.
МАПК фосфорилирует многие цитоплазматические белки: протеинкиназу pp90S6, белки рибосом, фосфолипазу А2, активаторы транскрипции (ПСАТ). Путь Ras активируется не только инсулином, но и многими другими гормонами и факторами роста. Многие компоненты этого пути являются продуктами протоонкогенов, мутации которых приводят к злокачественной трансформации клеток (см. раздел 16).
Эффекты инсулина могут проявляться в течение секунд и минут (транспорт веществ, фосфорилирование и дефосфорилирование белков, активация и ингибирование ферментов, синтез РНК) или через несколько часов (синтез ДНК, белков, рост клеток).
Активация фосфоинозитол-3-киназы (ФИ-3-киназы). Этот фермент катализирует фосфорилирование ФИ, ФИ-4-фосфата и ФИ-4,5-бисфос- фата в положении 3, образуя полифосфоинозитиды: ФИ-3-фосфат, ФИ-3,4-бисфосфат, ФИ- 3,4,5-трифосфат, которые в разных клетках стимулируют мобилизацию Са2+ и активацию специфических протеинкиназ (см. раздел 5). Активация ФИ-3-киназы стимулирует транслокацию ГЛЮТ-4 в плазматическую мембрану и таким образом ускоряет трансмембранный перенос глюкозы в клетки жировой и мышечной ткани. В жировой ткани активация ФИ-3-киназы приводит к торможению липолиза. Снижение скорости липолиза происходит в результате активации фосфодиэстеразы и уменьшения внутриклеточной концентрации цАМФ (рис. 11-26).
Рис. 11-26. Активация фосфодиэстеразы адипоцитов инсулином. 1 — фосфорилированный рецептор инсулина фосфорилирует субстраты инсулинового рецептора; 2 — образование комплекса фосфоинозитол-3-киназы (ФИ-3-киназы) с активированными субстратами инсулинового рецептора; 3 — активация протеинкиназы В (ПК-В); 4 — протеинкиназа В активирует фосфодиэстеразу (ФДЭ) путём фосфорилирования; 5 — ФДЭ катализирует реакцию превращения цАМФ в АМФ.

Активация гликогенсинтазы инсулином. Одной из протеинкиназ, активируемых через путь Ras, является протеинкиназа pp90S6. Этот фермент фосфорилирует протеинфосфатазу, связанную с гранулами гликогена. При фосфорилировании протеинфосфатаза активируется и дефосфорилирует киназу гликогенфосфорилазы, гликоген-фосфорилазу и гликогенсинтазу. Дефосфорилированные формы киназыфосфорилазы и гликогенфосфорилазы неактивны, вследствие чего мобилизация гликогена замедляется. Гликоген- синтаза, напротив, активируется, и синтез гликогена ускоряется (рис. 11-27).
Рис. 11-27. Активация гликогенсинтазы инсулином. 1 — активация пути RAS; 2 — протеинкиназа pp90S6, активируемая инсулином через путь RAS (рис. 11-25), фосфорилирует протеинфосфатазу гранул гликогена, которая включает каскад реакций дефосфорилирования; 3 — инактивация киназыфосфорилазы и гликогенфосфорилазы; 4 — торможение мобилизации гликогена; 5 — активация гликогенсинтазы; 6 — стимуляция синтеза гликогена.

Инсулин влияет на скорость транскрипции более, чем 100 специфических мРНК в печени, жировой ткани, скелетных мышцах и сердце. Впервые влияние инсулина на транскрипцию генов было показано на примере фосфоенол- пируваткарбоксикиназы — ключевого фермента глюконеогенеза, скорость синтеза которого в культуре клеток гепатомы снижалась в течение нескольких минут.
4. Глюкагон
Глюкагон — одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клетках островков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной железы главный пептид — глюкагон; в клетках кишечника образуются глюкагоноподобные пептиды (от англ. GLP — glucagon like peptide): GLP-1, GLP-2, глицентин и другие. GLP-1 ингибирует секрецию глюкагона и стимулирует синтез и секрецию инсулина. Стимулятором секреции GLP-1 служит другой гормон — желудочный ингибирующий полипептид (от англ. GIP — gastrial inhibitor peptide), который синтезируется в клетках слизистой оболочки верхних отделов тонкого кишечника. Секреция GIPстимулируется при приёме пищи; наиболее сильным стимулятором служит глюкоза. На секрецию глюкагона влияют и многие другие соединения, включая аминокислоты, жирные кислоты, кетоновые тела и нейромедиаторы. При приёме пищи, богатой углеводами, секреция глюкагона снижается. Белковая пища стимулирует секрецию инсулина и глюкагона; однако некоторые аминокислоты в большей степени влияют на секрецию одного из них. Например, аланин стимулирует секрецию глюкагона, но не инсулина.
В плазме крови глюкагон не связан с каким-либо транспортным белком. Т1/2 гормона составляет ~5 мин. В печени глюкагон быстро разрушается под действием специфических протеаз.
Эффекты глюкагона в основном противоположны эффектам инсулина. Основные клетки- мишени глюкагона — печень и жировая ткань. Связываясь с рецепторами на плазматической мембране клеток-мишеней, глюкагон повышает содержание цАМФ (см. раздел 5). В гепатоцитах это приводит к активации фосфорилазы гликогена и к снижению активности гликоген- синтазы. В результате ускоряется мобилизация гликогена. Фосфорилирование пируваткиназы и БИФ вызывает торможение гликолиза и ускорение глюконеогенеза. Кроме того, глюкагон стимулирует глюконеогенез, индуцируя синтез ферментов: глюкозо-6-фосфатазы, фосфоенол- пируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы (см. раздел 7). В клетках жировой ткани глюкагон через аденилатциклазный каскад активирует гормончувствительную ТАГ-липазу и стимулирует липолиз (см. раздел 8). Таким образом, в противоположность инсулину глюкагон стимулирует мобилизацию основных энергоносителей — углеводов и жиров.
5. Другие гормоны желудочно-кишечного тракта
Из тканей ЖКТ выделено более 10 биологически активных пептидов. Многие из них по механизму действия могут быть причислены к истинным гормонам, проявляющим эндокринный эффект. К ним относят гастрин, секретин, GIP, холецистокинин, мотилин, панкреатический полипептид и энтероглюкагон. Другие желудочно-кишечные пептиды обладают паракринным или нейроэндокринным действием: вазоактивный интестинальный пептид (VIP), соматостатин.
К особенностям эндокринной системы ЖКТ относят то, что её клетки рассеяны по разным отделам, а не собраны в отдельном органе. Многие желудочно-кишечные пептиды найдены в нервах ЖКТ, а также в клетках ЦНС. Кроме того, для пептидов ЖКТ характерно наличие множественных форм, имеющих структурное и функциональное сходство, что ограничивает возможности изучения их структуры и функции. Из главных желудочно-кишечных гормонов только секретин существует в единственной форме. Многие гормоны ЖКТ по сходству первичной структуры и функции могут быть отнесены к одному из 2 семейств.
Семейство гастрина объединяет гастрин и холецистокинин.
Семейство секретина объединяет секретин, глюкагон, GIP, VIP и глицентин.
Сравнительно мало известно о механизмах действия гормонов ЖКТ. На ацинарных клетках поджелудочной железы идентифицировано шесть разных классов рецепторов. Один из них для семейства гастрина функционирует при участии инозитолфосфатной системы; рецепторы секретина и VIР — компоненты аденилатциклазной системы. Биологическая роль основных гормонов ЖКТ рассматривается в курсе физиологии и в разделе 9.