СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
17. НЕРВНАЯ КЛЕТКА. НЕЙРОМЕДИАТОРЫ
❖ Нервная клетка. Нервная система организма осуществляет координацию деятельности специализированных клеток. Она осуществляет передачу нервного импульса от одной части тела к другой, в результате чего организм реагирует на раздражение как единое целое.
Централизованное управление организмом осуществляет центральная нервная система, включающая головной и спинной мозг. Связь органов и тканей с центральной нервной системой осуществляется с помощью периферической нервной системы путем передачи нервных импульсов.
Нервная ткань построена из нервных клеток - нейронов. Кора головного мозга человека содержит 10-20 миллиардов нейронов. Нейрон состоит из тела диаметром от 3 до 100 мкм, содержащего ядро и другие органеллы, и отростков. Выделяют два вида отростков: аксон - длинный отросток, осуществляющий проведение возбуждения от тела нейрона, и дендриты - обычно короткие и сильно разветвленные отростки. Нейрон может иметь несколько дендритов и обычно только один аксон.

Нервная система преобразует поступившие через органы чувств физические (свет, звук, температура, давление, прикосновение) или химические (от веществ, находящихся в воздухе, пище или жидкостях внутренних сред организма) раздражения в нервный импульс.
В основе этих преобразований лежат химические превращения биомолекул. Раздражающий сигнал воспринимается высокоспецифическим белком-рецептором, находящимся в возбудимой мембране. В результате такого взаимодействия изменяются конформация белка, проницаемость мембраны, активность связанного с мембраной фермента, ионный транспорт через мембрану, что приводит к многократному усилению ответа на первоначальный стимул. Функциональные изменения рецептора обратимы. Вторичный сигнал через нервные волокна поступает в центральную нервную систему, где он перерабатывается, и затем посылается ответный импульс на периферию.
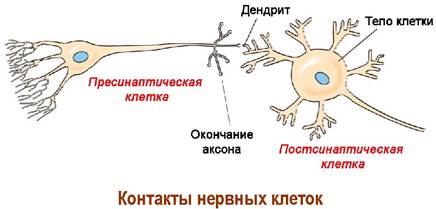
✵ Синапсы. Для нейронов характерно очень большое количество контактов между собой (до 20 000). Связь между нервными клетками осуществляется специализированной структурой - синапсом.

В нервном окончании клетки, передающей нервный импульс, находится пресинаптическая мембрана. Принимает этот нервный сигнал мембрана другой клетки - постсинаптическая мембрана. Между мембранами находится синаптическая щель шириной около 50 нм.
Химические посредники передачи сигнала - нейромедиаторы, продуцируются в области синаптического окончания с помощью специфических ферментов. Нейромедиаторы накапливаются (депонируются) в особых органеллах - синаптических пузырьках, диаметром до 50 нм. Обеспечивают проникновение в депо через липидную мембрану специальные трансмембранные каналы - везикулярные транспортеры нейромедиаторов.
Поляризация биомембраны нервной клетки при прохождении сигнала приводит к активации специализированных кальциевых каналов. В окончании нейрона возрастает концентрация Са2+-ионов. Связывание ионов кальция с белками мембраны синаптических пузырьков облегчает их слияние (экзоцитоз) с пресинаптической мембраной. Фиксирование пузырьков на клеточной мембране обеспечивается межмолекулярным взаимодействием специальных белков (SNARE-протеины).
В результате экзоцитоза происходит высвобождение порции нейромедиатора в синаптическую щель. Диффундируя через щель, сигнальные молекулы связываются со специфическими рецепторами постсинаптической мембраны, которые передают сигнал далее.
В регулировании работы синапса принимают участие рецепторы на пресинаптической мембране. Несвязанные молекулы нейромедиатора возвращаются с помощью транспортеров нейромедиаторов в нейрон или под действием специфических ферментов химически дезактивируются.
✵ Ботулинический токсин. Грамположительная бактерия Clostridium botulinum относится к анаэробным микроорганизмам. Очень часто отравление людей самодельными грибными, мясными или рыбными консервами связано с попаданием в них этих бактерий, которые при размножении выделяют токсины. Ботулинический токсин - самое ядовитое из известных химических веществ, его летальная доза составляет 1-10-5 мкг/кг.
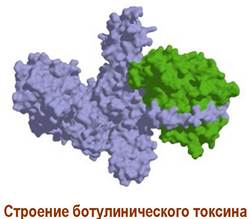
Структура токсина включает два домена, соединенных между собой дисульфидным мостиком. Больший домен (~100 кДа) отвечает за связывание токсина с SNARE-протеинами ацетилхолиновых синапсов (см. далее), а меньший (~50 кДа), обладающий протеазной активностью, разрушает структуру этих белков. Тем самым блокируется выхода ацетилхолина из синаптических пузырьков и прекращается передача нервных сигналов.
❖ Нейромедиаторы. Нервные импульсы от одного синапса к другому передаются с помощью химических веществ - нейромедиаторов (нейротрансмиттеров).
Первым химическим соединением, для которого была выявлена роль посредника при передаче нервного сигнала, является ацетилхолин. Это было сделано в 1921 г. американским фармакологом австрийского происхождения О. Лёви. В 1936 г. он совместно с английским нейробиологом Г. Дейлом получил Нобелевскую премию по физиологии и медицине «за открытия, связанные с химической передачей нервных импульсов».

К настоящему времени нейромедиаторная функция установлена более чем для десятка химических соединений. Ряд веществ исследуется в качестве возможных нейротрансмиттеров.
По химической природе нейромедиаторы подразделяют на:
♦ аминокислоты - глицин, y-аминомасляная кислота (ГАМК), глутаминовая кислота;
♦ пептиды, например, N-ацетиласпартилглутамат;
♦ биогенные амины - ацетилхолин, серотонин, гистамин, а также подгруппа катехоламинов (дофамин, норадреналин).
В зависимости от природы нейромедиатора выделяют несколько типов синапсов. Рассмотрим строение и механизмы передачи сигнала для некоторых из них.
Холинергический синапс
В окончании пресинаптического аксона в цитоплазме с участием ацетилкофермента А и фермента холинацетилтрансферазы осуществляется биосинтез ацетилхолина.

Выделившийся в синаптическую щель ацетилхолин связывается со специфическими холинорецепторами постсинаптической мембраны. Дальнейший гидролиз ацетилхолина до холина под действием фермента ацетилхолинэстеразы приводит к возвращению рецепторов в исходное состояние. А на основе поступающего в синапс холина вновь синтезируется ацетилхолин.

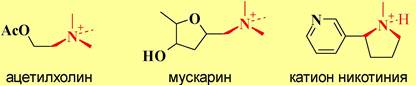
❖ Холинорецепторы представляют собой сложные гликопротеиновые комплексы. Они подразделяются в зависимости от активирующих веществ на никотин-чувствительные или н-холинорецепторы, и мускарин-чувствительные или м-холинорецепторы.
Первые из них обычно находятся на месте контакта аксонов со скелетными мышцами или в электрическом органе ската (рецепторы мышечного типа), а также в поверхностных слоях коры головного мозга (рецепторы нейронального типа). Вторые сосредоточены в мозге, секреторных клетках, гладких и сердечных мышцах.
Схожесть пространственного строения молекул ацетилхолина и протонированного никотина, а также ацетилхолина и мускарина объясняет действие этих алкалоидов на соответствующие рецепторы.
✵ м-Холинорецепторы подразделяются на пять подтипов:
♦ М1 - размещаются в клетках ЦНС;
♦ М2 - основной подтип м-холинорецепторов в сердце, а также пресинаптические М2-холинорецепторы, обеспечивающие снижение высвобождения ацетилхолина;
♦ М3 - присутствуют в гладких мышцах и в большинстве экзокринных желез;
♦ М4 - обнаружены в сердце, стенке легочных альвеол, ЦНС;
♦ М5 - выявлены в ЦНС, в слюнных железах, радужной оболочке глаза. Рецепторы данного типа относятся к метаботропным рецепторам. М1-, М3- и М5-рецепторы связаны с Gq-белками, а М2- и М4- рецепторы - с Gi-белками. Взаимодействие ацетилхолина с мускариновыми рецепторами вызывает снижение артериального давления, замедление сердечных сокращений, сужение зрачков, усиление секреции железами.
✵ н-Холинорецепторы. Никотиновый рецептор (например, электрического ската) представляет собой ионный канал и состоит из пяти субъединиц четырех типов (2α, и β, y, δ) с общей молекулярной массой около 290 кДа. Высота рецептора составляет около 12 нм, диаметр — ~9 нм.
Молекулы ацетилхолина связываются с α-субъединицами, структура рецептора изменяется и ионный канал диаметром около 2 нм открывается. Возрастает проходимость ионов Na+ внутрь клетки и ионов К+ из клетки, что вызывает деполяризацию постсинаптической мембраны и в конечном итоге приводит к возбуждению мышечной клетки и, как следствие, - к сокращению скелетной мускулатуры.

❖ Ацетилхолинэстераза представляет собой гликопротеин, в котором углеводная часть молекулы составляет около 8% по массе. Выявлены три изоформы фермента: АСhТ - основная, АСhER - эрицитарная и АChEH, встречающаяся у электрических скатов и мышей. Фермент из электрического ската и из бычьих эритроцитов состоит из 4 субъединиц, попарно соединенных дисульфидными мостиками. Каждая субъединица (молекулярная масса 70-80 кДа) имеет один активный центр. У человека преобладают связанные с мембраной тетрамерные и растворимые мономерные формы фермента.

✵ Механизм действия ацетилхолинэстеразы. Избыток молекул ацетилхолина, а также молекулы ацетилхолина, вышедшие в синаптическую щель из рецепторов после передачи сигнала, в течение 2 миллисекунд расщепляются ацетилхолинэстеразой.
Ацетилхолин связывается в активном центре фермента за счет образования ионной связи между карбоксилат-ионом и четвертичным атомом азота. Расщепление начинается с протонирования сложноэфирного атома кислорода протоном гидроксильной группы остатка тирозина. Гидроксильная группа остатка серина диссоциирует и нуклеофильный атом кислорода атакует карбонильный центр ацетильной группы. Остаток гистидина выступает в качестве переносчика протона. Далее ацилофермент гидролизуется с выделением уксусной кислоты.

✵ Фосфорорганические отравляющие вещества. Ядовитое действие фосфорорганических боевых отравляющих веществ (зарин, зоман, табун и др.) и фосфорорганических инсектицидов (хлорофос, дихлофос и т. п.) связано с фосфорилированием остатков серина в активном центре ацетилхолинэстеразы. Такой фосфорилированый аналог ацилофермента не способен гидролизоваться и тем самым блокируется гидролиз ацетилхолина. Увеличение концентрации этого нейромедиатора приводит к перевозбуждению нервной системы.

❖ Агонисты и антагонисты холинорецепторов. Свойства как агонистов, так и антагонистов рецепторов часто проявляют алкалоиды (см. следующую главу). Уже упоминались в качестве агонистов н-холинорецепторов и м-холинорецепторов, соответственно, никотин и мускарин. К агонистам н-холинорецепторов также относятся лобелин и анабазин, используемые в препаратах для отвыкания от курения. Алкалоид пилокарпин- агонист м-холинорецепторов.

Алкалоиды платифилин, атропин и скопаламин блокируют м-холинорецепторы, а d-тубокураринхлорид является антагонистом н-холинорецепторов. При попадании в кровь α-тубокурарин- хлорида происходит блокирование передачи нервного сигнала в скелетных мышцах и паралич дыхательной системы. В малых дозах он вызывает расслабления мышц. В хирургии в качестве миорелаксантов используют как α- тубокураринхлорид, так и его синтетические аналоги, например, теркуроний.
✵ Лекарственные препараты, действующие на холинэргические процессы. С фармацевтической точки зрения лекарственные средства (ЛС), влияющие на холинорецепторы, могут оказывать стимулирующий (холиномиметический) или угнетающий (холиноблокирующий) эффект.
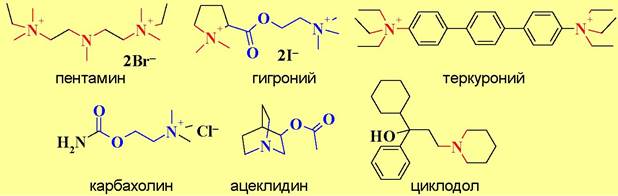
На холинэргические процессы могут влиять вещества, воздействующие не только на рецепторы, но и на другие компоненты этой системы. Например, карбахолин усиливает выделение ацетилхолина на уровне пресинаптических окончаний, а ботулинический токсин наоборот препятствует высвобождению медиатора.
Обратимые блокаторы ацетилхолинэстеразы (физостигмин, галантамин) сужают зрачок глаза и понижают внутриглазное давление, что позволяет их использовать при лечении глаукомы, а также для преодоления двигательных нарушений и ряда других заболеваний.

Таблица 13. Лекарственные препараты, действующие на холинэргические процессы
Тип ЛС |
ЛС |
Фармакологический эффект |
м-, н-холиномиметики |
карбахолин |
снижает внутриглазное давление, повышает тонус мышц кишечника |
м-холиномиметики |
пилокарпин |
снижает внутриглазное давление |
ацеклидин |
повышает тонус мышц внутренних органов, сужает зрачок, снижает внутриглазное давление |
|
н-холиномиметики |
анабазин, лобелин |
стимулируют дыхание, способствуют отвыканию от курения |
м-, н-холиноблокаторы |
циклодол |
уменьшает тремор при лечении паркинсонизма |
м-холиноблокаторы |
атропин |
расширяет зрачок, уменьшает секрецию желез, учащает сердцебиения |
платифиллин скопаламин |
снимает спазмы мышц желудка и кишечника, бронхов, кровеносных сосудов, расширяет зрачок противорвотное и успокаивающее действие |
|
н-холиноблокаторы |
пентамин, гигроний |
снимают спазмы мышц сосудов, понижают артериальное давление |
тубокурарин-хлорид, теркуроний |
миорелаксанты |
Адренергический синапс
❖ Адренергический синапс. В 1946 г. шведским физиологом У. фон Эйлером было установлено, что норадреналин аналогично ацетилхолину играет роль нейромедиатора. В 1970 г. он совместно с германо-британским биофизиком Б. Кацем и американским биохимиком Дж. Аксельродом удостоился Нобелевской премии по физиологии и медицине «за открытия в области изучения медиаторов нервных волокон и механизмов их сохранения, выделения и инактивации».
При адренергической передаче сигнала в окончании нервной клетки на основе аминокислот фенилаланина и тирозина осуществляется биосинтез норадреналина. Синтезированный норадреналин запасается в синаптических пузырьках. Проникновение через мембрану обеспечивает везикулярный норадреналиновый транспортер. При прохождении нервного импульса по аксону происходит высвобождение норадреналина в синаптическую щель. Этот процесс, как и в случае ацетилхолинового синапса, регулируется ионами кальция.

Молекулы норадреналина пересекают синаптическую щель и воздействуют на специальные адренорецепторы на постсинаптической мембране. Такие рецепторы располагаются как на периферических нервных окончаниях, так и синапсах центральной нервной системы. Норадреналин в основном выполняет функцию «медиатора бодрствования».
Молекулы нейромедиатора также способны активировать рецепторы на пресинаптических мембранах, снижая выброс норадреналина. Часть молекул через норадреналиновые транспортеры возвращаются обратно в окончание нервной клетки.
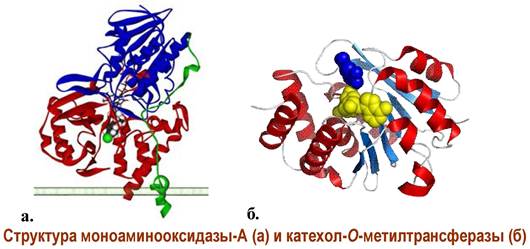
В деградации норадреналина принимает участие два фермента. Под действием моноаминооксидазы он окисляется до 3,4-дигидроксиминдальной кислоты (ДГМК). При катализе катехол-О-метилтрансферазой, происходит процесс инактивации избытка норадреналина в синаптической щели путем перевода его в норметиладреналин, а также ДГМК в 4-гидрокси-3- метоксиминдальную кислоту (ГММК).

❖ Адренорецепторы. Изучение действия различных производных адреналина позволило установить неоднородность адренорецепторов. Первоначально выделили два типа - α и β-рецепторы, которые в свою очередь подразделяются на подтипы α1-2 и β1-3. Все они относятся к метаботропным рецепторам, но разного типа.
✵ α1-Рецепторы расположены, в частности, на кровеносных сосудах и радиальной мышце радужки глаза. При активации вызывают сокращение гладких мышц и повышение артериального давления или сужение зрачка. Передача биологического сигнала осуществляется с участием Gq-белка через активацию фосфолипазы С (PL-C), что приводит к увеличению концентрации таких внутриклеточных медиаторов как диацилглицерин (DAG), инозинтрифосфат (IP3), ионы Са2+ и как итог активации протеинкиназы С.
✵ α2-Рецепторы находятся на пресинаптических мембранах адренергических синапсов и обеспечивают контроль за выделением норадреналина. При возрастании концентрации норадреналина в синаптической щели часть молекул нейромедиатора попадает на пресинаптические рецепторы, которые посредством α1-субъединицы Gi-белка ингибируют фермент аденилатциклазу (АС). Одновременно взаимодействие β, y-субъединичного блока с cАМР-фосфодиэстеразой (сАМР-РЕ) приводит к ее активации и, соответственно, гидролизу внутриклеточного медиатора сАМР. В конечном результате уменьшается концентрация сАМР и тормозится секреция норадреналина.
✵ β-Рецепторы. Основная локализация β1-рецепторов - постсинаптические мембраны в клетках сердечной мышцы. При их активации увеличивается число сердечных сокращений.
В отличие от вышерассмотренных адренорецепторов β2-рецепторы активируются не нейромедиатором норадреналином, а гормоном адреналином (см. ниже). Они находятся на поверхности клеток бронхов, почек, сосудов печени, мозга и других органов, а также на пресинаптических мембранах адренергических синапсов. В результате стимуляции этих рецепторов учащается сердцебиение, расширяются бронхи и сосуды, увеличивается продукция ренина почками, активируется секреция норадреналина.
Относительно недавно открытые β3-адренорецепторы находятся в клетках жировой ткани, и их активация стимулирует липолиз и, соответственно, выделение энергии.
Взаимодействие норадреналина и адреналина с β-рецепторами активирует аденилатциклазную систему, что приводит к увеличению продукции «вторичного» медиатора сАМР.

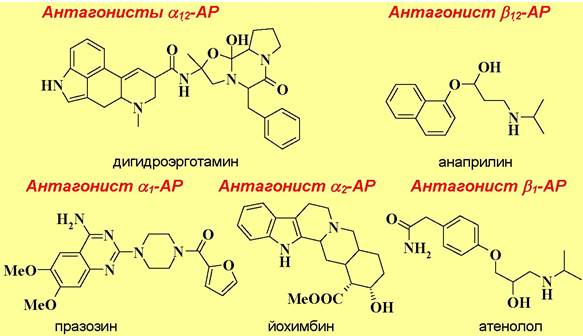
❖ Адреномиметики и адреноблокаторы. В медицине широко используется как сам адреналин, так и различные вещества стимулирующие (адреномиметики) или ингибирующие (адреноблокаторы) работу адренорецепторов. С точки зрения воздействия на рецепторы адреномиметики являются агонистами, а адреноблокаторы - антагонистами адренорецепторов.
Различают адреномиметики общего действия, например, эфедрин, и действующие отдельно на а-адренорецепторы сосудов и β- адренорецепторы сердца. К первой группе относятся: мезатон, являющийся более стойким аналогом адреналина и обладающий боле длительным действием; нафтизин (санорин), который при попадании на слизистые оболочки оказывает противоотечное действие; клофелин и его аналог трамазолин, снижающие артериальное давление.
Представителями второй группы являются: изадрин, который, не смотря на незначительные отличия в структуре по сравнению с адреналином - метильная группа заменена на изопропильную, не повышает артериальное давление, но стимулирует сердцебиение; сальбутамол - оказывает бронхорасширяющее действие, но не влияет на кровяное давление и не вызывает тахикардию (учащение пульса); добутамин - стимулятор сердечной деятельности.

В качестве лекарственных препаратов также используют соединения, блокирующие адренорецепторы, например, алкалоиды спорыньи, в том числе синтетическое производное дигидроэрготамин, являющиеся α- адреноблокаторами, неспецифический β-адреноблокатор анаприлин или кардиоселективный β-адреноблокатор атенолол, который в отличие от анаприлина не воздействует на бронхи.
Медиаторы - биогенные амины
❖ Катехоламины - природные амины, являющиеся производными пирокатехина. Их еще называют биогенными аминами, т.к. они синтезируются в организме из аминокислот фенилаланина и тирозина. В организме выполняют функции нейромедиаторов и гормонов.
В биосинтезе катехоламинов первоначально проходит гидроксилирова- ние фенилаланина до тирозина, а затем до 3,4-дигидроксифенилаланина (ДОФА - от устаревшего названия диоксифенилаланин).
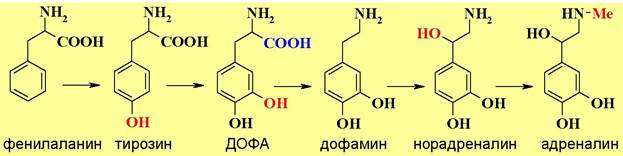
Окисление связи С-Н в бензольных кольцах этих аминокислот протекает с помощью специальных ферментов гидроксилаз. Гидроксилазы имеют одинаковую тетрамерную конструкцию и различаются строением каталитического домена.


В процессе окисления задействован кофермент тетрагидробиоптерин (ВН4), который в результате этой реакции отдает два атома водорода и превращается в дигидробиоптерин (ВН2).

Затем осуществляется декарбоксилирование ДОФА с образованием дофамина.

Последующее окисление в бензильном положении и N-метилирование последовательно дают норадреналин и адреналин.

✵ Дофамин способен действовать на специфические дофаминовые рецепторы:
♦ D1 - клетки ЦНС, почек, околощитовидной железы;
♦ D2 - клетки ЦНС, почек, гипофиза, гипоталамуса;
♦ D3 - клетки центра обоняния;
♦ D4 - клетки центра обоняния, гипоталамуса;
♦ D5 - клетки ЦНС.
D1 и D5-рецепторы связаны с GS-белками, активирующие аденилатциклазу. Связывание дофамина с D2 - D4-рецептороми приводит к стимуляции Gi-белков и снижению концентрации сАМР. При больших концентрациях дофамин активирует и адренорецепторы, однако, не прямым действием, а способствуя высвобождению норадреналина. Связывание дофамина со специфическими рецепторами почек приводит к расширению почечных сосудов и увеличивает почечную фильтрацию. Воздействуя на D2- рецепторы гипоталамуса, он ингибирует секрецию ряда нейропептидов гипофиза.
✵ Норадреналин является одним из основных веществ, участвующих в передаче нервных сигналов (см. выше).
✵ Адреналин вырабатывается надпочечниками и регулирует сердечную деятельность, обмен углеводов. Его называют «гормоном страха», так как он выделяется при стрессах, увеличивая частоту сердцебиения и дыхания.
❖ Серотонин (5-гидрокситриптамин) - биогенный амин, образующийся в организме декарбоксилированием 5-гидрокситриптофана, который в свою очередь образуется из триптофана при гидроксилировании ферментом 5- триптофан-гидроксилазой.

В качестве гормона и нейромедиатора он регулирует ряд физиологических и поведенческих процессов, включая сон, аппетит, память, сексуальную активность, агрессивность, галлюцинации. Серотонин также является одним из важных медиаторов процессов аллергии и воспаления, а также регуляторов моторики и секреции в желудочно-кишечном тракте.

Серотонин известен как «гормон хорошего настроения». Решающую роль в продукции серотонина играет свет, поэтому недостаток света в зимнее время года является причиной сезонной депрессии. Считается, что употребление в пищу продуктов с повышенным содержанием триптофана (инжир, финики, бананы, шоколад) также способствует улучшению настроения.
Серотонин, аналогично другим медиаторам, действует на специфические (серотониновые) рецепторы, находящиеся на поверхности клеток гладких мышц сосудов, бронхов, желудочно-кишечного тракта, ЦНС и др. К настоящему времени известно семь типов таких рецепторов, обозначаемых 5-НТ1 - 5-НТ7. Для некоторых из них выявлено несколько подтипов:
♦ 5-НТ1А,B,D,E,F; 5-НТ3; 5-НТ4; 5-НТ5АВ; 5-НТ6; 5-НТ7 — клетки ЦНС;
♦ 5-НТ2А — клетки гладкой мускулатуры и ЦНС;
♦ 5-НТ2В - клетки кишечника, сердца, почек, легких;
♦ 5-НТ2С - клетки спинного и головного мозга.
Рецепторы 5-НТ1 и 5-НТ5 связаны с Gi-белками, 5-НТ4, 5-НТ6 и 5-НТ7 - с Gs-белками, 5-НТ2 - с Gq-белками. Рецепторы 5-НТ3 являются ионными каналами.
Выявлено, что рецепторы 5-НТ1А на пресинаптических мембранах участвуют в регуляции продукции серотонина, а рецепторы 5-НТ7 - терморегуляции организма. Индукция рецепторов 5-НТ3 приводит к тошноте, раздражению кишечника, 5-НТ4 - повышает настроение, аппетит. Активация 5-НТ1В вызывает агрессию, 5-HT1D - беспокойство, сужение сосудов, 5-HТ1F - мигрень, 5-НТ2С - гипоактивность.
Взаимодействием с серотониновыми рецепторами связан механизм действия психотропных препаратов, в т. ч. антидепрессантов, галлюциногенов - действуют на 5-НТ2А-рецепторы, лекарственных веществ, подавляющих рвоту, соответственно на 5-НТ3-рецепторы. Блокировка 5-НТ2А, 5-НТ2С, 5-НТ6, 5-НТ7-рецепторов вызывает шизофрению.
❖ Мелатонин является производным серотонина. Этот гормон продуцируется клетками эпофиза и участвует в регуляции сна. За сутки в организме человека синтезируется около 30 мкг (70% ночью). С возрастом активность эпифиза снижается, соответственно, снижается продукция гормона, что приводит к ухудшению качества сна и возникновению бессонницы.
Выявлены рецепторы на мелатонин: МТNR1А, находящиеся в клетках гипофиза и гипоталамуса, и МТNR1В, локализованные в клетках ЦНС, сетчатки, клетках тканей легких. Оба типа рецепторов связаны с Gi-белками. Также рецепция мелатонина осуществляется внутриклеточными рецепторами ретиноидного типа.
Превращение серотонина в мелатонин катализируется двумя ферментами, которые могут последовательно действовать в любом порядке.

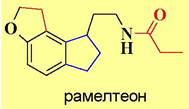
Близкое по строению к мелатонину лекарственное средство рамелтеон используется в качестве снотворного препарата. Это соединение является специфическим агонистом мелатониновых рецепторов.
В последнее время вырос интерес к мелатонину как стимулятору иммунитета и противоопухолевому препарату. Считается, что это связано с воздействие на внутриклеточные рецепторы ретиноидного типа. Кроме того, мелатонин является сильным эндогенным блокатором свободных радикалов.
❖ Гистамин также относится к биогенным аминам. Он образуется в организме декарбоксилированием аминокислоты гистидина и, в частности, выполняет функцию медиатора аллергических реакций.

В нормальном состоянии организма гистамин находится в связанном виде. При ряде патологических процессов (ожоги, аллергия, обморожения) высвобождается большое количество гистамина, который вызывает отек тканей и спазм гладких мышц, в том числе, в бронхах.
Развитие аллергических процессов связано с выделением плазмацитарными клетками антител класса IgE. Иммуноглобулины, в свою очередь, действуют на специфические рецепторы тучных клеток и в присутствии аллергена активируют выработку гистамина.

Установлены рецепторы (Н1 - Н4), на которые действует гистамин:
♦ Н1 - локализованы на клетках ЦНС, бронхов, кровеносных сосудов, ЖКТ;
♦ Н2 - присутствуют на клетках ЦНС, сердца, кровеносных сосудов, ЖКТ;
♦ Н3 - находятся на клетках ЦНС;
♦ Н4 - выявлены на иммунных клетках.
Все они относятся к метаботропным рецепторам. Рецепторы Н1 активируют Gq-белки, Н2 - Gs-белки, Н3 и Н3 - Gi-белки. Активация Н1-рецепторов вызывает сокращение мышц бронхов и кишечника, тогда как стимуляция Н2-рецепторов возбуждает некоторые отделы ЦНС, клетки миокарда, а также усиливает выделение желудочного сока. Н3- рецепторы на пресинаптических мембранах соответствующих синапсов участвуют в регуляции продукции гистамина.
✵ Лекарственные препараты, действующие на гистаминовые рецепторы. В зависимости от того на какой тип гистаминовых рецепторов действует лекарственное средство получается различный лечебный эффект. Препараты, блокирующие работу Н1-рецепторов, в основном используются как антигистаминные препараты противоаллергического действия. К ним, в частности, относятся димедрол, тавегил, супрастин, кларитин. Так как они взаимодействуют H1-рецепторами ЦНС, то для большинства из них характерно побочное снотворное действие.

В свою очередь такие лекарства как ранитидин и циметидин, являющиеся блокаторами Н2-рецепторов, широко используются в качестве противоязвенных препаратов.

Глутаматергический синапс
Глутаминовая кислота является одной из наиболее распространенных в природе аминокислот. Наряду с другими функциями глутаминовая кислота играет роль нейротрансмиттера в передаче нервного возбуждения. Это наиболее распространенный в нервной системе позвоночных возбуждающий нейромедиатор.
Для глутаминовой кислоты существуют традиционные пути биосинтеза, например, переаминирование α-кетоглутарата, протекающее с коферментным участием пиридоксальфосфата.

Также эта кислота образуется путем дезаминирования глутамина с помощью фермента глутаминазы.

Рецепция глутамата осуществляется с помощью метаботропным глутаматных рецепторов mGLuR1 - mGLuR8 и ионотропных рецепторов.
✵ Метаботропные рецепторы. Рецепторы подтипов mGLuR1 и mGLuR5 связаны с Gq-белками, а также взаимодействуют с Na+- и К+- каналами. Они в основном локализованы на постсинаптических мембранах. Остальные подтипы этих рецепторов обычно присутствуют на пресинаптических мембранах и реализуют биологические сигналы через Gi/0-белками.

Агонистом рецепторов mGLuR2 и mGLuR3также является N- ацетиласпартилглутамат (NAAG). Этот дипептид обладает всеми свойствами нейротрансмиттера - он накапливается в синаптических пузырьках, при передаче нервного сигнала порциями вбрасывается в синаптическую щель, активирует рецепторы и расщепляется специфическими ферментами.
✵ NMDA-рецептор представляет собой ионотропный глутаматный рецептор. Отличительным лигандом для данного типа рецепторов служит N- метил-D-аспарагиновая кислота (NMDA).

Ионный канал образован из двух блоков, содержащих по две субъединицы NR1 и NR2, которые в свою очередь имеют несколько подтипов. В регулировании работы рецептора участвует ион магния, который в пассивном состоянии закрывает канал, а в присутствии глутамата он удаляется и через открытый канал в клетку поступают катионы натрия и кальция, а из клетки выходят ионы калия.
Рецепторы данного типа также имеют участки связывания с глицином, который выступает в качестве соагониста глутамату. Также свойства природного агониста NMDA-рецепторов проявляет L-аспарагиновая кислота.
✵ АМРА-рецептор. Основной тип рецепторов глутамата. Специфическим агонистом этого типа рецепторов является α-3-амино-5-метил-4- изоксазолпропионовая кислота (АМРА). Четыре белковые субъединицы формируют ионный канал. Обычно реализуется два блока димеров, в состав каждого входит субъединица GluR2 и одна из субъединиц GluR1, GluR3 или GluR4. Существенно реже встречаются гомотетрамерные каналы, состоящие из субъединиц GluR1 или GluR2.

Каждая субъединица имеет три трансмембранных фрагмента и один внутримембранный домен. Два участка связывания лиганда S1 и S2 формируются внеклеточными полипептидными цепями. При взаимодействии с глутаматом эти сегменты сближаются, конформационные изменения передаются на внутримембранные цепи и канал открывается.
На селективность АМРА-рецептора влияет природа аминокислоты в Q/R-сайте домена ТМ2. Наиболее распространенные в нервной системе рецепторы содержат остаток аргинина и не пропускают ионы кальция.

✵ Каинатный рецептор. Аналогичен по организации АМРА-рецептору. Существенно меньше распространен в ЦНС по сравнению с рассмотренными выше ионотропными рецепторами. Специфический агонист - каиновая кислота.
В состав ионного канала могут входить субъединицы GluR5-GluR7, способные образовывать как гомо-, так и гетеромерные структуры. Также выявлены субъединицы КА1 и КА2, входящие в состав гетеротетрамерных рецепторов. Каинатный рецептор обеспечивает преимущественное прохождение через мембрану ионов натрия и калия и лишь в незначительной степени катионов Са2+.
Глицин - гамкергический синапс
y-Аминомасляная кислота (ГАМК) - биогенная аминокислота, являющаяся медиатором нервного торможения. Образуется в результате декарбоксилирования глутаминовой кислоты под действием фермента глутаматдекарбоксилазы.


Передача сигнала торможения ГАМК осуществляется совместно с глицином, который в этом случае также выполняет функцию нейромедиатора. На постсинаптической мембране ГАМК-глицинового синапса находятся рецепторы как на ГАМК, так и на глицин. Их активация приводит к согласованной передаче сигнала в клетку.
Механизм действия ГАМК связан с воздействием на специфические ГАМКергические рецепторы. Различают ГАМКА-, ГАМКВ- и ГАМКС- рецепторы. ГАМКА- и ГАМКС-рецепторы, также, как и глициновый рецептор, представляют собой анионные каналы. При действии ГАМК на участки связывания, находящиеся в области контактов α- и β-субъединиц, происходит изменение конформации белковых субъединиц и образуется ионный канал. Ионы хлора проходят по этому каналу внутрь клетки, вызывая процесс нервного торможения.
ГАМКВ-рецептор устроен аналогично а2-адренорецепторам и способен ингибировать аденилатциклазу, а также регулировать работу К+- и Са2+-каналов.
Стимуляция или блокирование этих ГАМК-рецепторов лежит в основе биологического действия ряда лекарственных препаратов (снотворных, противосудорожных, транквилизаторов и т. п.). Сама ГАМК является лекарственным средством, улучшающим работу головного мозга, активирующим память и мышление.
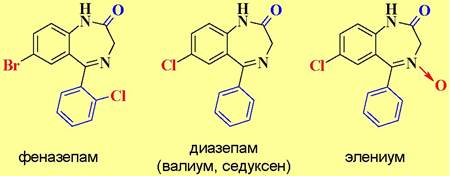
ГАМКА-рецептор имеет участки связывания с производными барбитуровой кислоты и бензодиазепина, которые проявляют снотворные и успокаивающие свойства. Этот же рецептор способен связываться с молекулами этилового спирта. Поэтому категорически запрещено употребление препаратов этих типов совместно со спиртными напитками, которые резко усиливают действие лекарств.

✵ Барбитураты. Производные барбитуровой кислоты широко используются как снотворные (веронал), успокаивающие (фенобарбитал) и анестезирующие (тиопентал-натрий) средства. В настоящее время их применение ограничено, так как они не способствуют нормальному физиологическому сну, а также вызывают эффект привыкания.

✵ Транквилизаторы группы 1,4-бензодиазепина. Транквилизаторы - вещества, снижающие чувство страха, тревоги, нервного напряжения. Препараты этой группы практически вытеснили барбитураты в качестве успокаивающих средств, т. к. у них меньше побочных действий.