БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 29. ЭУКАРИОТИЧЕСКИЕ ХРОМОСОМЫ И ВЫРАЖЕНИЕ ГЕНОВ У ЭУКАРИОТ
29.9. Митохондрии и хлоропласты содержат собственную ДНК
Не вся наследственная информация эукариотических клеток содержится в ядерной хромосомной ДНК. В результате генетических исследований дрожжей был открыт митохондриальный геном, отличный от ядерного генома. В 1949 г. Борис Эфрусси (Boris Ephrussi) обнаружил, что некоторые мутанты пекарских дрожжей не способны к окислительному фосфорилированию. Эти дефектные по дыханию мутанты медленно растут за счет брожения. Они называются petites (что по-французски означает «маленькие»), так как образуют очень маленькие колонии. Генетический анализ привел к неожиданному открытию, что мутации petites сегрегируют независимо от ядра; это навело на мысль о том, что митохондрии обладают собственным геномом. И действительно, через несколько лет в митохондриях была обнаружена ДНК. Более того, митохондриальная ДНК из штамма petite отличалась по плавучей плотности от митохондриальной ДНК дрожжей дикого типа; из этого следовало, что у мутанта изменена значительная часть митохондриального генома. Вслед за этим было показано, что хлоропласты фотосинтезирующих эукариот тоже содержат ДНК и что она реплицируется, транскрибируется и транслируется.
Митохондриальная ДНК животных клеток - кольцевая двухцепочечная молекула с контурной длиной около 5 мкм, что соответствует 15 kb. Дрожжевая митохондриальная ДНК обычно примерно в 5 раз длиннее, а хлоропластная - в 10 раз длиннее. Молекулы ДНК в митохондриях и хлоропластах не связаны с гистонами. Они относительно невелики, сравнимы по величине с вирусными геномами. Лучше всего изучен митохондриальный геном дрожжей, кодирующий примерно десять белков, две молекулы рибосомной РНК и около 26 видов транспортной РНК. Молекулы, кодируемые митохондриальной ДНК и синтезируемые внутри этой органеллы, составляют всего около 5% митохондриального белка. Таким образом, большая часть белков митохондрии кодируется ядерным геномом. Однако
генетический вклад митохондриальной ДНК необходим. Например, три из семи субъединиц цитохромоксидазы и три из десяти субъединиц АТРазы внутренней мембраны митохондрий кодируются митохондриальным геномом. Существование отдельных геномов влечет за собой ряд вопросов. Каким образом репликация митохондриальной ДНК координируется с удвоением хромосом и делением клетки? Как белки, синтезированные в цитозоле, проникают в митохондрии и взаимодействуют с продуктами митохондриальных генов? Но самое загадочное состоит в следующем: зачем митохондриям нужны собственные геномы, если 95% их белков кодируются ядерным геномом? Ответов на эти интригующие вопросы пока нет.
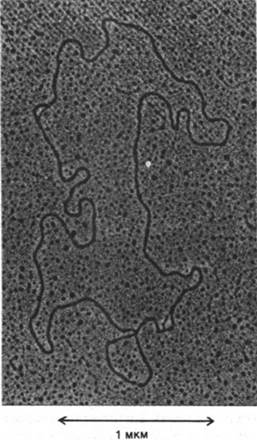
Рис. 29.16. Электронно-микроскопическое изображение молекулы митохондриальной ДНК, содержащей два генома, соединенных «голова к хвосту» с образованием кольца. Репликация этой молекулы ДНК только что началась. Стрелками показаны две петли, расположенные на противоположных сторонах кольца. Эти петли с вытесненной цепью (D-петли, от англ. displacement - вытеснение) содержат новосинтезированную ДНК. Более тонкая линия в каждой петле - вытесненный одноцепочечный участок родительской ДНК
29.10. Эукариотическая ДНК содержит много повторяющихся последовательностей оснований
Рой Бриттен (Roy Britten) и его сотрудники исследовали кинетику реассоциации ДНК, денатурированной нагреванием, и обнаружили, что эукариотическая ДНК в отличие от прокариотической ДНК содержит много повторяющихся последовательностей оснований. В этих экспериментах ДНК дробили на короткие фрагменты и затем денатурировали нагреванием раствора выше температуры плавления ДНК (Тпл). Затем полученный раствор одноцепочечной ДНК охлаждали до температуры примерно на 25°С ниже Тпл, оптимальной для реассоциации комплементарных цепей с образованием двухспиральной ДНК. Кинетику реассоциации можно регистрировать самыми различными способами. Один из методов состоит в измерении поглощения раствора при 260 нм (разд. 24.9). При этой длине волны коэффициент поглощения двухцепочечной ДНК примерно на 40% ниже, чем соответствующая величина для одноцепочечной ДНК; это явление называется гипохромизмом. В основе другого экспериментального подхода лежит тот факт, что двухцепочечная ДНК связывается колонками с гидроксиапатитом (фосфатом кальция), а одноцепочечная проскакивает. В этом методе привлекает то, что он позволяет фракционировать большие количества ДНК на основе скорости ее реассоциации после тепловой денатурации.
Наблюдаемая кинетика реассоциации ДНК Е. coli или фага Т4 соответствует ожидаемой кинетике бимолекулярной реакции
![]()
где S и S' - комплементарные одноцепочечные молекулы, Б - реассоциировавшая двойная спираль и k - константа скорости ассоциации. В такой реакции доля одноцепочечных молекул f снижается со временем в соответствии с уравнением
![]()
где С0 - исходная концентрация ДНК (выраженная в молях нуклеотидов в 1 л), а t - время в секундах. Для определенной ДНК и заданных экспериментальных условий (т. е. ионной силы, температуры, размера фрагментов ДНК) f зависит только от С0t - произведения концентрации ДНК на время. Кинетику реассоциации удобно графически изображать, откладывая зависимость f от десятичного логарифма С0t. Такая кривая С0t имеет сигмоидную форму (рис. 29.17). Характеристикой того или иного препарата ДНК служит величина С0t0,5, которую легко определить с помощью этой кривой. C0t0 ,5 - значение C0t, при котором происходит реассоциация половины ДНК (f= 0,5). Для ДНК Е. coli значение C0t0, 5составляет примерно 9 М • с, для фага Т4 C0t 0,5 = 0,3 М • с. Эти числа показывают, что ДНК Е. coli реассоциирует примерно в 30 раз медленнее, чем ДНК фага Т4. Объясняется это тем, что ДНК Е. coli длиннее и число разных видов фрагментов, которые содержатся в препарате ДНК, разрушенной силами сдвига, больше, чем в препарате ДНК Т4. Итак, концентрация комплементарных фрагментов в растворе фрагментированной ДНК Е. coli ниже, чем в растворе ДНК фага Т4 (содержащем такое же количество нуклеотидов), и, следовательно, скорость реассоциации ниже. Исследование ряда прокариотических ДНК показало, что величина C0t0, 5 прямо пропорциональна размеру генома.
Рис. 29.17. Кривые зависимости f от C0t («кривые C0t») отображают кинетику реассоциации нескольких денатурированных нагреванием ДНК. По оси ординат отложена доля одноцепочечных молекул, по оси абсцисс - C0t. Быстрая реассоциация сателлитной ДНК мыши показывает, что она содержит огромное количество повторяющихся последовательностей

Когда с помощью этого метода стали исследовать ДНК мыши, получили неожиданный результат. Геномы млекопитающих примерно на три порядка величины больше, чем геном Е. coli,и предполагалось, что будет получена величина C0t0, 5 порядка 104 М • с. Раствор ДНК с концентрацией 10-4 М и с такой величиной C0t0,5должен реассоциировать наполовину за 108 с (примерно 3 года). К удивлению исследователей, они обнаружили, что 10% ДНК мыши реассоциирует наполовину за несколько секунд. Эта фракция ДНК мыши реассоциирует быстрее, чем даже самые маленькие вирусные ДНК, и, следовательно, содержит много повторяющихся последовательностей. Анализ кривой зависимости f от C0t показал, что эта фракция мышиной ДНК содержит порядка миллиона копий повторяющейся последовательности длиной около 300 пар оснований. Примерно 20% мышиной ДНК ренатурирует с промежуточной скоростью. Этот факт, согласно интерпретации авторов, указывал, что данная фракция содержит 103—104 копий определенных последовательностей. Остальные 70% мышиной ДНК ренатурировали очень медленно. Величина C0t0 ,5 для этой фракции показывала, что она состоит из уникальных или почти уникальных последовательностей оснований.
Все изученные до настоящего времени эукариотические геномы, кроме, возможно, дрожжей, содержат повторяющиеся последовательности ДНК, тогда как прокариоты ее не содержат. Например, человеческая ДНК на 30% состоит из последовательностей, повторяющихся по меньшей мере 20 раз. Относительное содержание высокоповторяющейся, умеренно повторяющейся и уникальной ДНК различно у разных видов.
29.11. Высокоповторяющаяся ДНК (сателлитная ДНК) локализована в центромерах
Многие высокоповторяющиеся ДНК можно выделить методом центрифугирования в градиенте плотности, так как их плавучая плотность отличается от плотности основной ДНК. Например, ДНК Drosophila virilis дает главный пик и три сателлитных пика с меньшей плотностью (рис. 29.18). Эти сателлитные пики содержат исключительно повторяющуюся ДНК. Каждая из них представляет собой повторяющуюся последовательность гептануклеотидов:

Рис. 29.18. На этой кривой седиментации видны три отчетливых пика сателлитной ДНК (р = 1,692, 1,688 и 1,671). Показан результат равновесного центрифугирования ДНК D. virilis в нейтральном градиенте CsCl

Роль высокоповторяющейся ДНК неизвестна. Но хромосомная локализация этой фракции была определена с помощью метода гибридизации in situ, разработанного Джозефом Голлом и Мэри Лу Пардью (Joseph Gall, Mary Lou Pardue). Клетки иммобилизовали под тонким слоем агара и обрабатывали щелочью для денатурации ДНК. Затем этот препарат инкубировали с меченной тритием РНК, транскрибированной in vitro очищенной сателлитной ДНК в качестве матрицы. Гибриды радиоактивной РНК с участками хромосомы, содержащими сателлитную ДНК, выявляли с помощью радиоавтографии (рис. 29.19). Был получен очень четкий результат: сателлитная ДНК мыши встречается только в области центромер. Локализация этих последовательностей и отсутствие в клетке комплементарных им РНК объясняются, по-видимому, тем, что сателлитные последовательности участвуют в перемещениях хромосом во время митоза и мейоза.
Рис. 29.19. Радиоавтограф мышиных клеток, на котором видна локализация сателлитной ДНК

Рис. 29.20. Микрофотография ядра, выделенного из ооцита ксенопуса. Ядро окрашено, чтобы были видны сотни ядрышек, образующихся при амплификации генов рибосомной РНК
