БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.4.Механізм дії ферментів
7.4.2.Етапи ферментативного каталізу
Формування ферментосубстратного комплексу. Той факт, що ферменти є високоспецифічними, дозволив у 1890 р. висунути гіпотезу, згідно з якою активний центр ферменту є комплементарним субстрату, тобто відповідає йому як "ключ замку». Після взаємодії субстрату ("ключ") з активним центром ("замок") відбуваються хімічні перетворення субстрату на продукт. Активний центр при цьому розглядався як стабільна, жорстко детермінована структура.
У 1959 р. був запропонований інший варіант гіпотези "ключ- замок", що пояснює події в активному центрі ферменту. За цією гіпотезою активний центр є гнучкою структурою щодо субстрату. Останній, взаємодіючи з активним центром ферменту, викликає зміну його конформації, приводячи до формування ферментосубстратного комплексу, сприятливого для хімічної модифікації субстрату. При цьому молекула субстрату також змінює свою конформацію, що забезпечує вищу ефективність ферментативної реакції. Ця "гіпотеза індукованої відповідності" пізніше отримала експериментальні докази.
Послідовність подій під час ферментативного каталізу. Процес ферментативного каталізу умовно можна поділити на такі етапи (рис. 7.12).
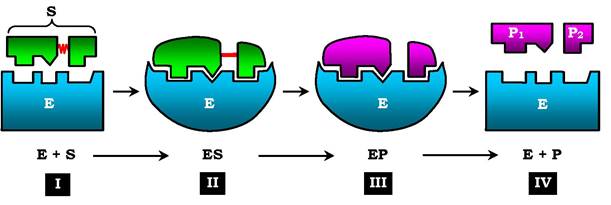
Рис. 7.12. Етапи ферментативного каталізу:
І - етап зближення й орієнтації субстрату відносно активного центру ферменту; ІІ - утворення ферментосубстратного комплексу (ES) у результаті індукованої відповідності; ІІІ - деформація субстрату й утворення нестабільного комплексу фермент - продукт (ЕР); IV - розпад комплексу (ЕР) з вивільненням продуктів реакції з активного центру ферменту та звільнення ферменту
Перший, другий і четвертий етапи каталізу нетривалі й залежать від концентрації субстрату (для першого етапу) і від констант зв'язування лігандів в активному центрі ферменту (для першого й третього етапів). Зміни енергетики хімічної реакції на цих етапах незначні. Третій етап найповільніший; його тривалість залежить від енергії активації хімічної реакції. На цій стадії відбувається розрив зв'язків у молекулі субстрату, утворення нових зв'язків і формування молекули продукту.
Роль активного центру у ферментативному каталізі. У результаті досліджень було установлено: молекула ферменту, як правило, у багато разів більша за молекулу субстрату, що піддається хімічному перетворенню цим ферментом. У контакт із субстратом вступає лише невелика частина молекули ферменту, зазвичай від 5 до 10 амінокислотних залишків, які формують його активний центр. Роль інших амінокислотних залишків полягає в забезпеченні правильної конформації молекули ферменту для оптимального перебігу хімічної реакції.
Активний центр на всіх етапах ферментативного каталізу не можна розглядати як пасивну ділянку для зв'язування субстрату. Це комплексна молекулярна "машина", яка використовує різноманітні хімічні механізми, що сприяють перетворенню субстрату на продукт.
В активному центрі ферменту субстрати розміщуються таким чином, щоб задіяні в реакції функціональні групи субстратів розташовувались безпосередньо одна біля одної. Цю властивість активного центру називають ефектом зближення й орієнтації реагентів. Таке впорядковане розміщення субстратів викликає зменшення ентропії та, як наслідок, зниження енергії активації (Еа), що визначає каталітичну активність ферментів. Активний центр ферменту також сприяє дестабілізації міжатомних зв'язків у молекулі субстрату, що полегшує перебіг хімічної реакції та утворення продуктів. Цю властивість активного центру називають ефектом деформації субстрату (рис. 7.12).