БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 2.РОЛЬ ВОДИ, МАКРО- І МІКРОЕЛЕМЕНТІВ У ЖИТТЄДІЯЛЬНОСТІ ОРГАНІЗМІВ
2.2. Зв'язана вода
Як видно з рис. 2.1, молекула води може приєднати дві інші молекули води за допомогою двох своїх протонів. Але інші молекули води можуть приєднатись до неї за рахунок їхніх власних протонів, тобто молекула Н2О може бути одночасно донором і акцептором двох Н-зв'язків. Акцепторні Н-зв'язки "прив'язані" до орієнтації донорних Н-зв'язків, утворюючи разом з ними чотири зв'язки, направлені до вершин тетраедра. Електричні заряди локалізовані у його вершинах (рис. 2.1) - два від'ємні та два позитивні зі значеннями ± 0,171 е - на віддалі 0,099 нм від ядра атома кисню. Це означає, що кожна молекула води виявляється координованою чотирма іншими у вершинах тетраедра, до того ж два зв'язки для розміщеної в центрі молекули є донорними, а два - акцепторними. Одночасно кожна молекула є також вершиною двох інших тетраедрів із молекул Н2О. Головною особливістю побудованих таким чином структур є те, що це в'язь, а не щільні структури (нагадують результат роботи в'язальниці, а не каменяра). Звідси легкість, ажурність структур із молекул води: при шильній укладці кульок з радіусом 0,14 нм (а це молекулярний радіус молекули Н2О з м. м. 18) густина була б 1,92 г/ см3. Реальна ж густина льоду, в якому молекули води «дотикаються» різнойменними полюсами, становить 0,92 г/ см3, що свідчить про підтримку водневими зв'язками «повітряної його конструкції».
Таким чином, ажурність і наявність внутрішніх пустот є одною з основних властивостей в'язей із молекул Н2О. Структура льоду побудована із взаємозчеплених кілець (рис. 2.5).
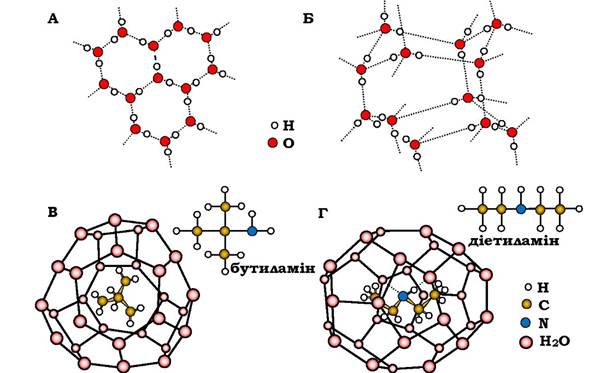
Рис. 2.5. Структури з води:
А - лід у проекції на базисну площину; Б - вигляд фрагмента, що повторюється; В - клатратний бутиламіновий;
Г - напівклатратний діетиламіновий гідрати (пунктирні лінії в Г - водневі зв'язки молекули гостя з молекулою води)
Три молекули води верхнього кільця і три з нижнього утворюють тригранну призму, в яку може бути вписана куля з радіусом 0,146 нм, який торкається всіх шести молекул води, що містяться у вершинах призми. Важливо, що простір усередині таких призм залишається порожнім не тільки в льоді, а й значною мірою в рідкій воді. Оскільки рідка вода лише на 10 % щільніша від льоду, підвищення щільності відбулося за рахунок заселення цих порожнин іншими молекулами води.
Лід не є прикладом найрихлішої зі структур, які мають каркас молекул води. Розшифрування структур газогідратів показало: зберігаючи той самий тип координації міжмолекулярних віддалей, що й у льоді, в'язь із молекул води утворює просторіші клітки - клатрати (кліткові гідрати). Реально такий каркас може бути стійким, коли в порожнинах є будь-які молекули чи атоми, які називаються "гостями" (рис. 2.5, В і Г: гості - бутиламін і діетиламін). Кількість таких молекул досягає 8 молів на елементарну структуру (комірку) із 46 молів Н2О. Збільшення стабільності структури за рахунок заселення пустот називають «ефектом хелп-газу» (допоміжного газу). Великий внесок у стабільність таких гідратів роблять вандерваальсові взаємодії гостьових молекул з водою.
Якщо молекула-гість здатна активніше взаємодіяти з молекулами води (як донор, чи акцептор Н-зв'язків), тоді стійкість гідрату зростає. Це приводить до деяких відхилень геометрії полімерів порівняно з поліедрами з «гідрофобними гостями». Такі геометричні зміни можуть бути значними аж до об'єднання кількох порожнин в одну зі заміною молекул води, які перебували на стику сусідніх порожнин, на групи гостьових часток. Зрозуміло, що загальна кількість води в таких структурах зменшується. Гідрати з наявністю описаних Н-зв'язків є напівклатратами.
Спостерігається закономірність: кількість зв'язаної води максимальна для гідратів гідрофобних речовин (благородні гази, метан, хлор, азот, кисень, двоокис вуглецю та ін.). За типом клатрації воду зв'язують і малорозчинні речовини (часто це означають як напівклатрацію), молекули яких можуть бути донорами чи акцепторами водневих зв'язків. До цих речовин відносять алкани, меркаптани, циклічні ефіри, аліфатичні аміни, кетони, спирти. Зокрема, етиловий спирт при - 80 0С кристалізується як суміш клатратів, напівклатратів і напівгідратів (в останньому молекули води уже не утворюють власні в'язі). Ще менше води мають кристалогідрати водорозчинних речовин. Вміст води знижується в ряду: гідратовані феноли, альдегіди, пурини, піримідини, амінокислоти, пептиди та вуглеводи. Для таких речовин клатрація практично не зустрічається. Молекули води, як правило, зв'язані Н-зв'язками лише з активними центрами - донорами й акцепторами Н-зв'язків - на поверхні гідрофільних молекул, або виконують функцію наповнювача каналів і пустот в органічному чи неорганічному каркасі.
Одночасно зі зменшенням вмісту води зростає і стабільність гідратів - "сила зв'язування» води даною речовиною. Якщо клатратні гідрати гідрофобних речовин розпадаються близько 0 0С, то для гідратів слабкорозчинних речовин температура розпаду (плавлення) досягає 20-30 0С. Гідратовані водорозчинні речовини стійкі при вищих температурах. Деякі з них плавляться у власній кристалізаційній воді (~100 0С). Деякі пастки утримують воду при 500 0С і вище, наприклад у силікатах. При дуже високих температурах (1000-1200 0С) дегідратація не зумовлена зчепленням молекул води зі структурою. Причина в дуже вузькій «горловині» - 0,2 нм, яка веде всередину порожнини, в якій міститься всього одна молекула Н2О.
Підходячи до питання про роль зв'язаної води в біосистемах, необхідно зауважити, що існує великий дефіцит кількісного фактичного матеріалу, який піддається фізичному аналізу. Тому основні роботи в цьому напрямі присвячені побудові різних гіпотез і екстраполяції до живих систем усього того, що відомо про воду простіших структур, у тому числі мінералів. Згідно з однією з таких класифікацій, зв'язана вода утримується в породі за рахунок хімічних і фізичних сил зв'язку (0,1-800 кДж/моль), які діють з боку мінералів, змінюють структуру і властивості води.
Зв'язану воду можна поділити на два типи. Перший - це вода кристалічної решітки, до якої відносять конституційну, кристалізаційно-зв'язану воду різних кристалогідратів, а також воду, зв'язану координаційно-ненасиченими атомами та іонами кристалічної решітки. До другого типу належить адсорбційна вода, яка утворюється за рахунок адсорбційного "притягання" молекул води до активних адсорбційних центрів поверхні молекул. Серед цього типу є два різновиди зв'язаної води: а) вода мономолекулярної адсорбції з енергією притягання до поверхні > 40 кДж/моль; б) вода полімолекулярної адсорбції з енергією зв'язку < 40 кДж/моль. Зв'язана вода утворює адсорбційні плівки товщиною в один чи кілька молекулярних шарів. У цього типу води фізичні властивості найбільше відрізняються від вільної води.
Вода перехідного типу (від зв'язаної до вільної) менше підлягає дії поверхневих сил. Вона утримується поблизу поверхні молекул за рахунок слабкіших зв'язків. Тому її структура менш змінена, а відмінності у фізичних властивостях порівняно з вільною водою не істотні. У межах перехідного типу також виділяють два види води: осмотично-поглинуту й капілярну. Перший вид утворюється за рахунок процесів вибіркової дифузії молекул води в напрямку до поверхні молекули, зумовленої наявністю в цій молекулі «іонної атмосфери» - подвійного електричного шару. Цей шар складається з катіонів розчину, які компенсують від'ємний заряд часток (рис. 2.6).
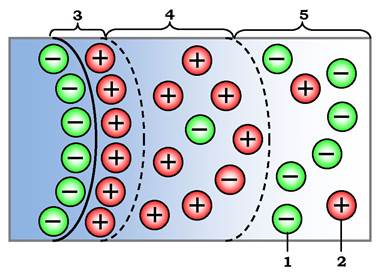
Рис. 2.6. Утворення осмотично-поглиненої води на зарядженій частці: 1 - аніони; 2 - катіони; 3 - область абсорбційного шару зайнята міцно зв'язаною водою; 4 - дифузна частина подвійного електричного шару, зайнятого осмотичною водою; 5 - область за межами подвійного електричного шару, зайнятого вільною водою
Подвійний електричний шар має дві частини: внутрішню, яка називається адсорбційним шаром (3), і зовнішню - дифузний шар (4). Концентрація катіонів експоненціально зростає по нормалі до поверхні частки. Це зумовлює наявність градієнта концентрації, який викликає "осмотичне" переміщення молекул води з об'єму вільного порового розчину (5) у межі подвійного електричного шару (4). Утворена таким чином осмотична вода займає зовнішню частину подвійного електричного шару - дифузний шар (4). Осмотичною цю воду назвали тому, що її утворення пов'язане з явищем мікроскопічного поверхневого осмосу, який нагадує звичайний макроскопічний осмос - рух води через напівпроникну мембрану (вода проходить, більші катіони затримуються) за дії градієнта концентрації.
Роль такої "напівпроникної мембрани» в макромолекулах виконує зовнішня межа подвійного електричного шару (рис. 2.6). З цією категорією води тісно пов'язана здатність багатьох систем набухати - збільшувати об'єм при поглинанні вологи.
Другий вид води перехідного типу - капілярна вода. Вона утворюється в порах капілярного розміру (діаметром 10-3-103 мкм) за рахунок капілярного тиску й утримується капілярними силами водних менісків (силами поверхневого натягу), які утворюються на межі фаз "вода - повітря - тверда поверхня". Капілярні сили практично не змінюють структури води, тому капілярна вода за основними фізичними властивостями практично не відрізняється від вільної води.