БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 11. СТРУКТУРА І ВЛАСТИВОСТІ ВУГЛЕВОДІВ
11.1. Моносахариди
Моносахариди (прості цукри, монози) - білі, кристалічні, гігроскопічні, добре розчинні у воді речовини, солодкі на смак. Розчини моносахаридів мають нейтральну реакцію, оптично активні, здатні до мутаротації.
За кількістю атомів вуглецю в молекулі моносахариди класифікують на тріози, тетрози, пентози, гексози, гептози тощо. Моносахариди за хімічною природою є полігідроксіальдегідами або полігідроксикетонами; залежно від форми оксогрупи в молекулі монози їх називають альдозами або кетозами:
![]()
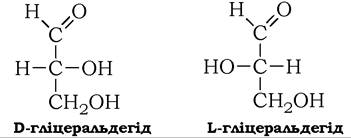
Для моносахаридів характерна оптична стереоізомерія, зумовлена наявністю в молекулах моноз асиметричних атомів вуглецю (асиметричний атом, або хіральний центр, - це атом вуглецю, в якому всі чотири валентності заміщені різними атомами або групами). Кількість оптичних ізомерів моноз дорівнює 2п (де n - кількість хіральних центрів у молекулі цукру). Найпростіший із моносахаридів - гліцеральдегід має один асиметричний атом вуглецю й тому може існувати у вигляді двох стереоізомерів: D-гліцеральдегіду і L-гліцеральдегіду. Літери D і L позначають абсолютну конфігурацію атомів при асиметричному атомі вуглецю:
D і L - стереоізомери гліцеральдегіду - є конфігураційними стандартами, за якими визначається відносна конфігурація інших моноз шляхом порівняння конфігурації тетраедра передостаннього атома вуглецю молекули моносахариду з тим чи іншим стереоізомером гліцеральдегіду.
Більшість природних моносахаридів мають D-конфігурацію і по суті є діастереомерами, тобто стереоізомерами, які відрізняються конфігурацією тетраедрів одного чи декількох асиметричних атомів вуглецю. Вони утворюють D-ряд цукрів, складові якого можна розглядати як похідні D-гліцеральдегіду, що містять його асиметричний атом вуглецю. Це останній хіральний центр у карбоновому ланцюзі молекул моносахаридів D-ряду.
Кожній альдозі та кетозі D-ряду відповідає стереоізомер L-ряду, який є дзеркальним відображенням відповідної D-форми. Такі "дзеркальні" стереоізомери називають енантіомерами.
Стереоізомери моносахаридів, які різняться конфігурацією тетраедрів одного з асиметричних атомів вуглецю, називають епімерами:
Моносахариди існують у двох молекулярних формах: ациклічній (лінійній) і циклічній (напівацетальній):
Утворення циклічної форми відбувається внаслідок внутрішньомолекулярної реакції між карбонільною і спиртовою групами, у результаті чого до карбонільного кисню наближається атом водню гідроксилу з утворенням циклу за рахунок зв'язування атомів вуглецю карбонільної групи та кисню гідроксильної групи. При цьому виникає новий хіральний центр і гідроксильна група біля атому вуглецю, що входив до складу карбонільної групи.
Найстійкіші напівацеталі утворюються за участю гідроксилів четвертого та п'ятого атомів вуглецю молекули цукру. Тому цикли можуть бути п'яти- або шестичленними.
П'ятичленне кільце моносахаридів називається γ-окисним і за будовою відповідає гетероциклічній сполуці - тетрагідрофурану:
![]()
Шестичленне кільце моноз називається δ-окисним і відповідає будові тетрагідропірану:
![]()
За пропозицією Р. Хеуорса монози з γ-окисним кільцем називають фуранозами, - з δ-окисним кільцем - піранозами. Самі ж циклічні форми моносахаридів зображують так, щоб однозначно трактувати розміщення атомів водню та гідроксильних груп відносно площини кільця. За Хеуорсом, цикли розміщують таким чином, щоб атоми кисню в кільцях були якнайдалі від ока спостерігача, а найближчі до нього зв'язки між атомами вуглецю зображують жирними лініями:
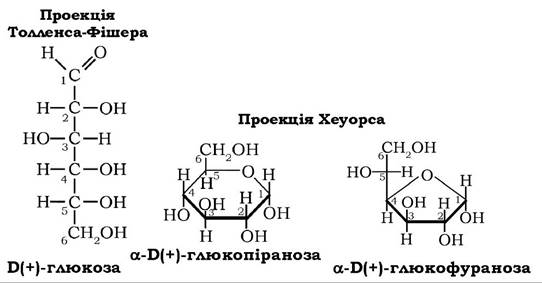
Замінники біля атомів вуглецю, які у формулах Б. Толленса розташовані зліва, розміщуються над кільцем, а ті, що справа - під площиною кільця. У проекційній формулі Хеуорса шостий атом вуглецю в карбоновому ланцюзі D-стереоізомера монози(формули Толленса) міститься над площиною кільця ізомеру й під кільцем у випадку L-стереоізомера. Незвичне розташування водню біля С5 у цих формулах зумовлено сприятливим для утворення кільця розміщенням гідроксильної групи атома вуглецю-5 після повороту п'ятого тетраедра навколо зв'язку С4-С5.
За розміщенням гідроксилу відносно аномерного атома вуглецю-1, що виникає при утворенні циклічних форм моноз, визначають а- і β-аномери. Перебування а- і β-аномерів моноз одночасно у фуранозних і піранозних формах зумовлено явищем кільчасто- ланцюгової таутомерії:
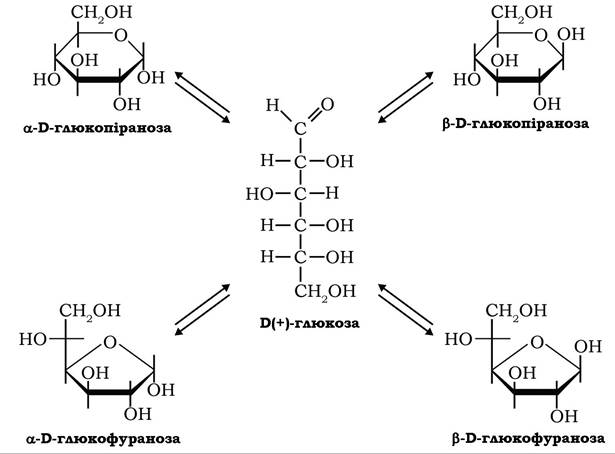
Таутомерні форми моноз перебувають у стані динамічної рівноваги і залежно від умов мутаротують з однієї таутомерної форми в іншу.
У стані рівновагі в нейтральних водних розчинах D-глюкози при температурі 20 °С переважають піранози: близько 64 % β-D-глюкопіранози та 36 % a-D-глюкопіранози. У водному розчині D-фруктози за цих умов частка β-D-фруктофуранози становить 76,4 %, a-D-фруктофуранози - 19,5 %.
Згідно з даними структурних досліджень молекул гексоз, піранозні цикли можуть існувати у вигляді восьми конформаційних ізомерів (конфігурацій) з різною енергетикою - двох кріслоподібних і шістьох човноподібних:
Для природних сахаридів характерним є найбільш енергетично виправдані дві кріслоподібні конфігурації піранозних циклів, які зазвичай зображують у вигляді просторових проекційних формул:
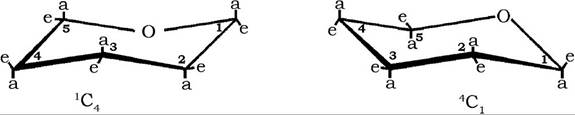
При позначенні кріслоподібних конформерів за номенклатурою Рівза попереду літери С (від англ. chair - крісло) надрядково ставлять номер атома вуглецю, розташованого над площиною кільця, і підрядково після літери - номер вуглецю, який міститься нижче площини кільця.
Цей спосіб зображення молекул моносахаридів у вигляді конформаційних ізомерів дозволяє розкрити реакційну здатність гідроксильних груп. Так, гідроксили піраноз, які розташовані у формулі в екваторіальній (е) площині, більш реакційноздатні, ніж ті, що знаходяться в аксіальній (а) позиції.
Гідроксил при аномерному атомі вуглецю більш реакційноздатний порівняно з іншими гідроксигрупами. Цей напівацетальний (глікозидний) гідроксил легко реагує зі спиртами з утворенням ефірів (ацеталів), які називаються глікозидами:
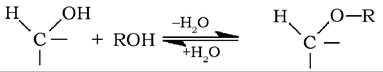
Відповідно до аномеру, який реагував зі спиртом, утворений глікозид називають а- або β-глікозидом.
У молекулах глікозидів - похідних моносахаридів, у яких атом водню напівацетального гідроксилу заміщений алкільним або іншим радикалом, замісник називається агліконом. Відповідно до того, який атом сполучає аглікон із залишком монози, глікозиди поділяються на O-, N- і S-глікозиди. Серед найпоширеніших у природі О- і N-глікозидів (рослинні пігменти, флавоноїди, алкалоїди тощо) переважають β-форми, наприклад аденозин, який утворюється в реакції між D-рибозою та аденіном:

Хімічні властивості моносахаридів зумовлені наявністю глікозидного та спиртових гідроксилів. Глікозидний гідроксил здатний взаємодіяти з гідроксигрупами інших моноз із утворенням глікозидного зв'язку, за участю якого створюються молекули оліго- та полісахаридів:

Метилюючі реагенти заміщують атоми водню в усіх гідроксилах моноз на метильні радикали:

Крім утворення ефірів спиртові гідроксили беруть участь у реакціях ацилювання:

Як напівацетальний гідроксил, так і первинний спиртовий гідроксил альдоз можуть легко окиснюватися до карбоксильних груп. При окисненні альдегідної групи слабкими окиснювачами (гідроксид міді, бромна вода) утворюються одноосновні альдонові кислоти. Сильніші окиснювачі (концентрована азотна кислота) окиснюють і альдегідну, і первинну спиртову групи з утворенням двоосновних гідроксикислот, які називаються альдаровими. За попереднього захисту альдегідної групи можливе окиснення тільки первинної спиртової групи з утворенням альдуронових кислот:

При відновленні альдегідної групи утворюються відповідні багатоатомні спирти - гліцити:

За участю аномерного атома вуглецю утворюються також тіонапівацеталі:

Оксогрупи моноз у реакції з гідроксиламіном утворюють розчинні у воді та спиртах оксими:
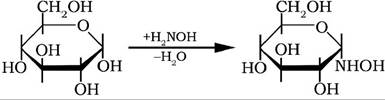
Взаємодія моносахаридів з фенілгідразином приводить до утворення озазонів, які кристалізуються у вигляді жовтих кристалів, що й використовують для виділення та ідентифікації моноз, оскільки і альдози, і кетози утворюють єдиний продукт - озазон.
У реакції з бензальдегідом озазони перетворюються в озони:

У слабкокислому середовищі альдегідна група озонів відновлюється до первинної спиртової, завершуючи тим самим перехід від альдоз через озазони та озони до кетоз:

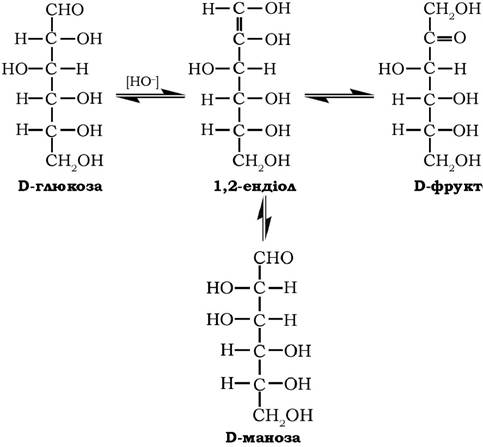
У слабколужному середовищі моносахариди зазнають епімерних перетворень, зумовлених енолізацією моноз:
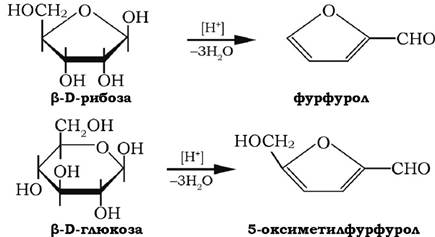
У кислому середовищі за наявності мінеральних кислот відбувається реакція внутрішньомолекулярної дегідратації моноз, яка приводить до утворення фурфуролу та 5-гідроксиметилфур-фуролу, здатних конденсуватися з різними фенолами й утворювати характерні забарвлені сполуки. На цьому базуються численні реакції ідентифікації моноз.
Біологічно важливі моносахариди. Незважаючи на те, що основний внесок у загальну кількість моноз у природі роблять гексози: глюкоза, фруктоза й галактоза, інші моносахариди також беруть участь у процесах життєдіяльності як структурні одиниці в складі оліго- та полісахаридів або як самостійні активні речовини.
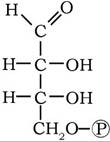
Тріози (СзНбОз). Дві важливі тріози D-гліцеральдегід-3-фосфат і дигідроксіацетонфосфат функціонують у клітинах мікроорганізмів, рослин і тварин як проміжні продукти вуглеводного та ліпідного обміну:

Тетрози (С4ШО4). Важливою тетрозою є D-еритрозо-4-фосфат, що утворюється в реакціях пентозофосфатного шляху катаболізму вуглеводів:
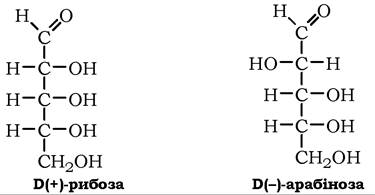
Пентози (С5Н10О5). Серед природних пентоз зустрічаються альдози: D-ксилоза, D-рибоза, L-арабіноза та кетози: D-рибулоза, D-ксилулоза.
В(+)-ксилоза може існувати як у фуранозній так і в піранозній формах у складі рослинних полісахаридів - пентозанів (ксилан), найчастіше у формі р^(+)-ксилопіранози:
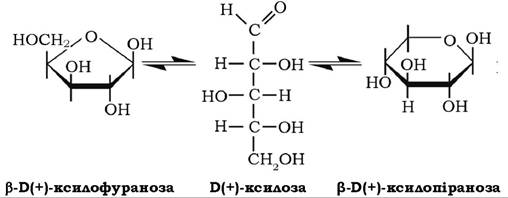
У складі ксилану вона присутня в соломі, деревині, оболонках зерен і в іншій рослинній сировині. Ксилоза добре розчиняється у воді, мутаротує з однієї форми в іншу, оптично активна сполука, кут питомого обертання якої у стані динамічної рівноваги таута- мерів становить + 18°. Ксилоза може окиснюватися у ксилонову та тригідроксиглутарову кислоти, у результаті відновлення вона перетворюється на п'ятиатомний спирт - ксиліт:
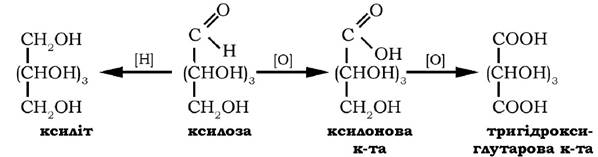
Ксилоза використовується в харчовій промисловості як підсолоджувач, а її похідне - тригідроксиглутарова кислота - як замісник лимонної кислоти.
Б(+)-Рибоза може перебувати в циклічній і ациклічній формах, але у водних розчинах вона існує переважно у формі D-рибофуранози:
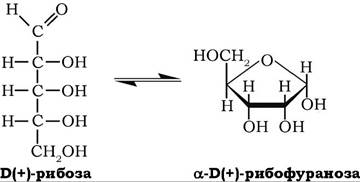
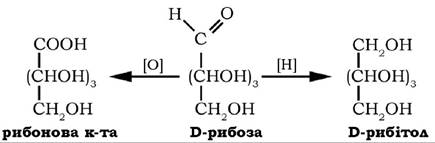
Кут її питомого обертання у водному розчині [a]D° = 23,7o. D-рибоза є складовою частиною нуклеотидів, коферментів, нуклеїнових кислот. Може утворюватися з D-глюкози при її окисненні на пентофофатному шляху. При окисненні рибози утворюється одноосновна рибонова кислота, при відновленні - п'ятиатомний спирт - рибітол
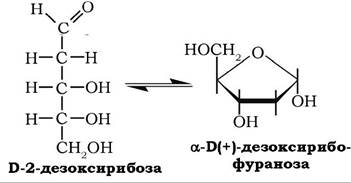
Б(+)-Дезоксирибоза також, як і D-рибоза, входить до складу нуклеотидів і нуклеїнових кислот (ДНК). Може перебувати в ациклічній і циклічній (фуранозній) формах:
Ц+)-Арабіноза досить поширена в природі, входить до складу глікозидів, олігосахаридів, полісахаридів (пектину, геміцелюлози, гуміарабіку, арабінану тощо) як у піранозній, так і у фуранозній формах:
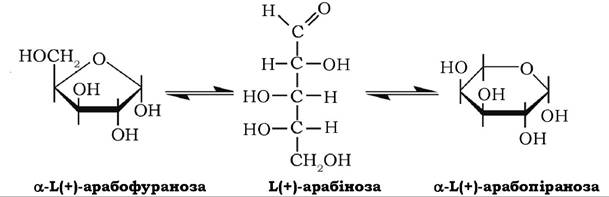
Арабіноза може окиснюватися в одноосновну арабонову кислоту й відновлюватися з утворенням багатоатомного спирту арабіту.
Кетопентози и(+)-ксилулоза і П(+)-рибулоза у вигляді фосфатних похідних, відомі як проміжні метаболіти пентозофосфатного шляху окиснення глюкози (див. розд. 12, п. 12.1.4).
Гексози (СбНі2Об) - найпоширеніші моносахариди, які у вільному та зв'язаному стані містяться у тканинах рослин і тварин, а також як мономери у природних оліго- та полісахаридах. Це аль- догексози - глюкоза, маноза, галактоза і кетогексоза - фруктоза:
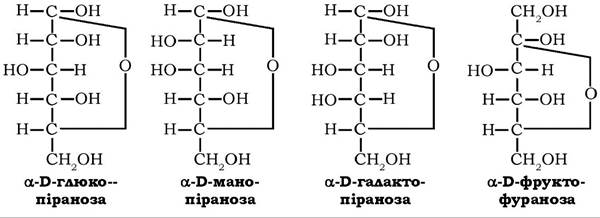
Розрізняються альдогексози тільки конфігураціями другого та четвертого тетраедрів: глюкоза й маноза є епімерами по вугле- цю-2; глюкоза й галактоза - епімерами по вуглецю-4. Кетогексоза фруктоза відрізняється від інших гексоз положенням аномерного атома вуглецю.
Усі гексози солодкі кристалічні речовини, легкорозчинні у воді, які кристалізуються з розчинів у вигляді моно- та напівгідра- тів; слабкорозчинні в метанолі, етанолі, піридині; важкорозчинні або нерозчинні в ефірі, вуглеводнях.
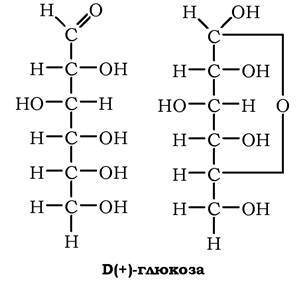
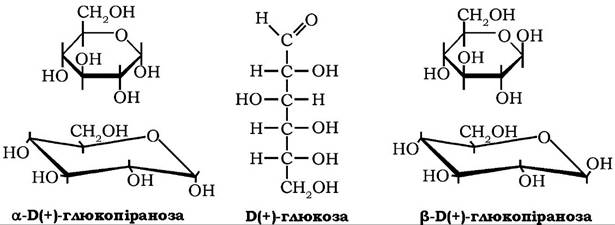
а-Б(+)-Глюкоза (декстроза, виноградний цукор) за хімічною будовою є альдогексозою, яка може перебувати в ациклічній і циклічній формах. Глюкоза добре розчиняється у воді, розчинна в піридині, метанолі, етанолі.
Кристалізується з розчинів у вигляді моногідрату, кут питомого обертання [α]D20 = 52,5o. Глюкоза - найпоширеніший у природі моносахарид, що у вільному стані міститься у великій кількості в насінні, квітках, плодах, листі рослин, входить до складу біологічних рідин організму тварин (кров, лімфа), є мономером у молекулах оліго- та полісахаридів, насамперед у сахарозі, лактозі, крохмалі, глікогені, целюлозі. Крохмаль і целюлоза є тією природною сировиною, з якої й добувають глюкозу шляхом ферментативного та кислотного гідролізу. Саме так отримують кристалічну гідратну (М = 198) та ангідридну (М = 18°) глюкозу, яку використовують у харчовій і фармацевтичній промисловості, зокрема в синтезі аскорбінової кислоти.
Б(-)-фруктоза (левульоза, фруктовий цукор) належить до кетогексоз. Фруктоза у вільному стані міститься у плодах, бджолиному меді (до 45 %). Вона - найсолодший цукор, у 2,5 рази солодший за глюкозу. Фруктоза входить як мономер до складу оліго- сахаридів - сахарози, рафінози, кестози та полісахариду інуліну.
У клітинах тварин присутня головним чином у вигляді фосфоефірів-фруктозо-6-фосфату і фруктозо-1,6-дифосфату - проміжних метаболітів катаболізму глюкози.
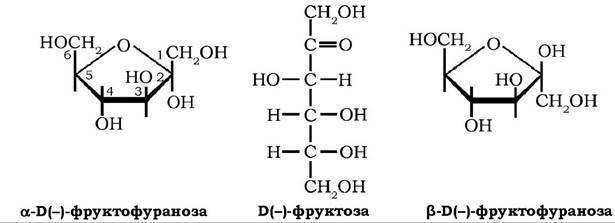
Фруктоза легко розчиняється у воді, кут питомого обертання її розчину становить - 92,5°, кристалізується у вигляді напівгідрату (С6Н12О6)2-Н2О, температура плавлення якого дорівнює 102,5-103,5 °С. У промисловості фруктозу отримують гідролізом сахарози або інуліну. Використовують у харчовій промисловості, дієтичному харчуванні хворих на діабет.
Б(+)-Галактоза (цереброза) належить до альдогексоз.
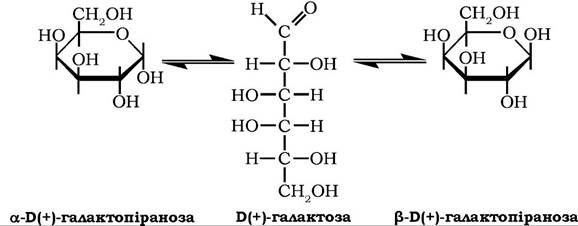
У стані рівноваги між ациклічною та аномерними формами питоме обертання її водного розчину [α]D20 = 81°.
Безводна а-D(+)-галактопіраноза має температуру плавлення 169 °С. У природі існує у вільному стані, а також входить до складу олігосахаридів: рафінози, мелібіози, стахіози, полісахаридів агар-агару, галактанів, гуміарабіку тощо. У тканинах тварин галактоза міститься в молекулах олігосахаридів лактози та її похідних, глікопротеїнів, цереброзидів. Використовується в мікробіологічній і кондитерській промисловості. Добувають галактозу гідролізом лактози або галактанів.
Б(+)-Маноза належить до альдогексоз. У водних розчинах у стані динамічної рівноваги між ациклічною формою і а- тв β-ано- мерами має кут питомого обертання дорівнює +14,5°
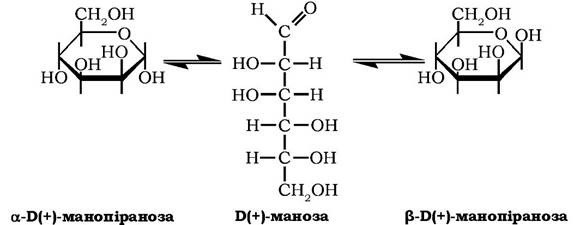
Маноза у вільному стані міститься в ячмені та кірці апельсинів, входить до складу рослинних поліоз мананів. Манозу виявлено у складі біологічних рідин тварин: крові, слини, слизу, суглобної рідини. Отримують манозу ізомеризацією глюкози або гідролізом мананів.
Похідні моносахаридів. Поряд з моносахаридами в життєдіяльності організмів беруть участь і похідні моноз: аміноцукри, цукрові та сіалові кислоти тощо.
Аміноцукри. Ці похідні моносахаридів утворені внаслідок заміщення гідроксильної групи одного з атомів вуглецю аміногрупою.
Широко розповсюджені у природі 2-аміноальдогексози: D-глю- козамін, D-галактозамін і D-манозамін, які зазвичай присутні в тканинах рослин і тварин у вигляді N-ацетильних похідних - N-ацетил-α-D-глюкозаміну, N-ацетил- α-D-галактозаміну та N-ацетил- α-D манозаміну:
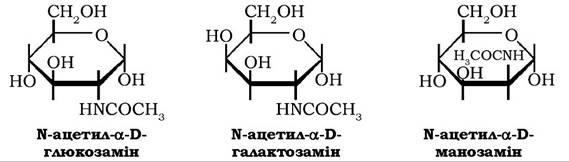
N-ацетильні похідні аміноцукрів є складовими молекул основного полісахариду зовнішнього скелета комах, молюсків і ракоподібних - хітину, полісахаридів плазмі крові, глікопротеїнів, хондроїтинсульфатів, деяких сфінголіпідів.
Разом з N-ацетильними похідними у природі зустрічаються N-метильні та фосфорильовані похідні аміноцукрів. Аміноцукри та їхні похідні виконують в організмах тварин специфічні функції в складі склоподібного тіла, синовіальної рідини, слизових речовин тощо.
Цукрові кислоти утворюються в результаті окиснення альдегідної, оксиметильної або одразу двох цих груп у молекулі альдози.
До них належать альдонові, альдуронові та альдарові кислоти:
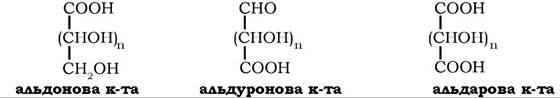
Під час окиснення D-глюкози утворюються D-глюконова, D-глюкуронова та D-глюкарова кислоти. Це сильні кислоти, які дають розчинні нейтральні солі. Найпоширенішою у природі є глюкуронова кислота, яка зустрічається у вільному стані, входить до складу глікопротеїнів крові, полісахаридів сполучної тканини, ксиланів, камедей.
Вільна глюкуронова кислота виконує в організмі тварин і людини важливу функцію детоксикації та виведення різних токсичних речовин - ксенобіотиків і кінцевих продуктів обміну у вигляді їхніх конг'югатів з глюкуроновою кислотою - глюкуронідів. Це відбувається шляхом зв'язування сполук глікозидним зв'язком (фенолів, стероїдів), або ефірним зв'язком (білірубіну). Продукт окиснення галактози - галактуронова кислота присутня в пектинових речовинах, рослинних і деяких полісахаридах мікроорганізмів.
Цукрові кислоти можуть утворювати внутрішні ефіри або лактони з п'яти- чи шестичленним кільцем. Наприклад, аеробне окиснення глюкози за участю глюкозооксидази з плісені Penicillium notatum приводить до утворення δ-глюконолактону:
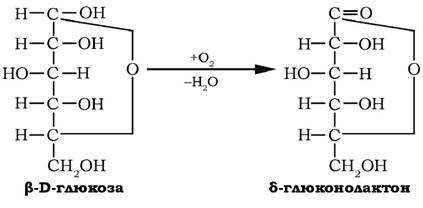
На цій реакції специфічного окиснення D-глюкози базується глюкозооксидазний метод кількісного визначення глюкози в розчинах.
Салові кислоти є ацильними похідними 3,5-дидезокси-5-амінононулоновї кислоти (нейрамінової кислоти). Нейрамінову кислоту можна розглядати як продукт конденсації D-манозоаміну та пірувату. Відомо декілька N- i O-ацильних і гліколільних похідних цієї кислоти, які утворюються шляхом приєднання ацетильної (гліколільної) групи до аміно- або гідроксильних груп нейрамінової кислоти:
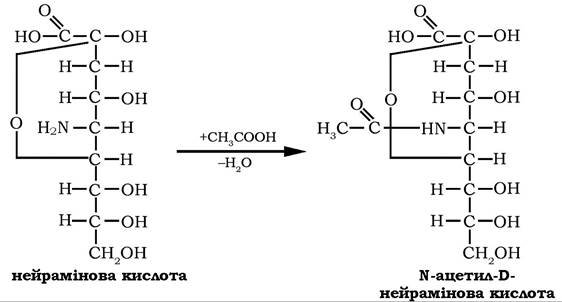
Сіалові кислоти є структурними компонентами глікопротеїнів і гліколіпідів плазматичних мембран клітин тварин. У складі гангліозидів беруть участь у функціонуванні нервової системи.