БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 2.РОЛЬ ВОДИ, МАКРО- І МІКРОЕЛЕМЕНТІВ У ЖИТТЄДІЯЛЬНОСТІ ОРГАНІЗМІВ
2.4. Макро- і мікроелементи
Необхідні для життєдіяльності організму неорганічні речовини можна поділити на дві групи: макро- та мікроелементи. Цей поділ умовний, хоч і має цифрові значення. Якщо масова частка елемента в організмі перевищує 10-2 % - це макроелементи. Частка мікроелементів в організмі становить 10-3-10-5 %. Якщо частка елемента нижче ніж 10-5 %, його відносять до ультрамікроелементів.
Усі неорганічні елементи (табл. 2.2) необхідні будь-якому організмові. Без достатньої кількості їх не можуть відбуватися основні фізико-хімічні й біохімічні процеси та реакції організму на зовнішні впливи. Це пояснюється тим, що макроелементи (Са і Р) входять до складу кісток (Са10(РО4)6(ОН)2), хлор (СІ) - до складу соляної кислоти шлункового соку, Nа і K, локалізуючись по обидва боки плазматичної мембрани, забезпечують генерацію і проведення електричних потенціалів. Мікроелементи входять до складу акцесорних речовин: дихальних пігментів, вітамінів, гормонів, ферментів і коферментів, які беруть участь у регуляції процесів життєдіяльності, впливають не тільки на активність ферментів, а й на направленість їхньої дії, через що мікроелементи називають «каталізаторами каталізаторів».
Мікроелементи потрібні для організмів лише в оптимальних кількостях. Нестача їх у поживних речовинах, як і надлишок, викликають захворювання й загибель організмів від хвороб обміну речовин. Мікроелементи беруть участь у таких важливих біохімічних процесах, як дихання (мідь, цинк, марганець, кобальт), фотосинтез (марганець, мідь), синтез білків (марганець, кобальт, мідь, нікель, хром), кровотворення (кобальт, мідь, марганець, нікель, цинк), білковий, вуглеводневий і жировий обміни речовин (молібден, ванадій, кобальт, вольфрам, марганець, цинк) тощо. Характерною ознакою необхідного елемента є дзвоноподібний вигляд кривої доза (n) - реакція (R), як це зображено на рис. 2.7.
Більшість мікроелементів є металами, з яких більше половини - перехідні (d-елементи). До перехідних відносять ті елементи, в яких у нейтральних вільних атомах d- і f-атомні орбіталі заповнені електронами. В організмі вони утворюють координаційні сполуки з біомолекулами. Так, марганець входить до складу 12 ферментів, залізо - 30, мідь - 30, а цинк - до понад 100 ферментів.
Таблиця 2.2
Добова потреба хімічних елементів в організмі людини і характерні симптоми їхнього дефіциту
Катіони, аніони |
Добова потреба, мг |
Типовий симптом при дефіциті |
|
дорослі |
діти |
||
K+ |
2000-5500 |
530 |
Зниження електричних характеристик мембран. Зі старінням організму їхні градієнти концентрації знижуються. |
Na+ |
1100-3300 |
260 |
« - » |
Са2+ |
800-1200 |
420 |
Уповільнення росту скелету. |
Mg2+ |
300-400 |
60 |
Судоми м'язів. |
Zn2+ |
15 |
5 |
Ушкодження шкіри, уповільнення статевого дозрівання. |
Fe2+ |
10-15 |
7 |
Анемія, порушення імунної системи. |
Mn2+ |
2,0-5,0 |
1,3 |
Уповільнення росту скелету, безплідність. |
Cu2+ |
1,5-3,0 |
1,0 |
Порушення функції печінки, вторинна анемія. |
Mo2+ |
0,08-0,25 |
0,06 |
Уповільнення клітинного росту, схильність до карієсу. |
Cr2+ |
0,05-0,20 |
0,04 |
Симптоми діабету. |
Co2+ |
0,18-0,22 |
0,001 |
Злоякісна анемія. |
Cl- |
3200 |
470 |
Зниження електричних параметрів. |
PO43- |
800-1200 |
220 |
Уповільнення росту кісток. |
SO42- |
10 |
- |
Уповільнення синтезу сірковмісних амінокислот. |
I- |
0,15 |
0,07 |
Порушення роботи щитоподібної залози. |
Se2- |
0,05-0,07 |
- |
М'язова (у т. ч. серцева) слабкість. |
F- |
1,5-4,0 |
0,6 |
Карієс зубів. |
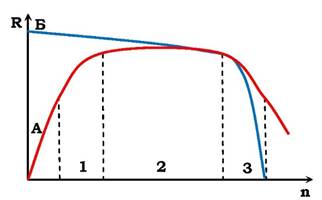
Рис. 2.7. Залежність реакції (R) біологічної системи від дози (n) життєво необхідного (А) і шкідливого (Б) елемента:
1 - основна відповідь; 2 - норма реакції; 3 - токсична дія елемента
Значна частина хімічних елементів є отрутами для живих організмів (табл. 2.3). За винятком берилію і барію, ці елементи утворюють стабільні сульфідні сполуки. Причина дії отрут пов'язана з блокуванням певних функціональних груп (у тому числі сульфгідрильних) білків, або заміною у ферментах їхніх "корисних" мікроелементів (табл. 2.3). Як видно з рис. 2.7, до певної концентрації цих елементів організм ніби не відчуває їхньої шкідливої дії. У разі значних концентрацій вони стають отрутами. Це свідчить, що концентрація будь-якого елемента в організмі відіграє істотну роль, не меншу, ніж тип елемента.
Таблиця 2.3
Розміщення токсичних елементів у періодах і групах системи Менделєєва
Період |
Групи |
||||||
I |
II |
III |
IV |
V |
VI |
VIII |
|
II |
- |
Be |
- |
- |
- |
- |
- |
IV |
- |
- |
- |
- |
As |
Se |
Ni |
V |
Ag |
Cd |
- |
- |
Sb |
Te |
Pd |
VI |
Au |
Ba Hg |
Tl |
Pb |
Bi |
- |
Pt |
Організм людини (70 кг) вміщує: Са 1700 г (у тому числі 1050 г у кістках), K - 250 г, Na - 70 г, Mg - 42 г, Fe - 5 г, Zn - 3 г, Cu - 10 мг, Mn - 20 мг, Co - 5 мг, Cr - 5 мг. Серед металоїдів переважають P - 700 г, S - 175 г, Cl - 105 г. Проте іонний склад тканин і рідин організму дуже варіює. Кров морських тварин за вмістом Na, K, Ca, Mg і Cl близька до морської води. У крові прісноводних і наземних організмів у 10 разів менше K і N і в кілька разів - Ca і Mg. Разом з тим, через вибіркову проникність плазматичних мембран і накопичення іонів клітини багаті на K і Mg, але мало мають N і Ca. Окремі види вибірково накопичують елементи. Так, плауни накопичують Al, деякі бактерії - Fe, тютюн - Zn, кукурудза - Au і Zn, мухомор - ванадій, усі бобові - молібден, ванадій тощо. У волоссі й нігтях накопичуються Al, As, I і V; у нирках - Cd, Hg і Mn; у тканинах кишечнику - Sn; у передміхуровій залозі - Zn і Sr; у мозку - Сu, а у слизовій очей - барій. Навіть такий елемент як кремній входить до складу шкіри, хрящів, зв'язок (до 0,01 %), до складу мукополісахаридів (дерматан- і гепарансульфати (~0,04 %)), утворюючи ефірні зв'язки типу
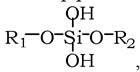
які відіграють роль містків між ланцюгами поліпептидів та ін.
Уже тільки тому, що вміст перехідних металів в організмах незначний, можна зробити припущення, що їхня функція має бути зв'язана з каталізом. Окрім цього, перехідні метали можуть виконувати (разом із біомолекулами) ще й інші функції - переносити електрони, групи атомів і цілі молекули, закріплювати молекули в певній орієнтації, повертати їх, поляризувати тощо. На
приклад, іони Zn є необхідними компонентами для сотень ферментів. Вони присутні в дегідрогеназах, які каталізують перенесення гідрид-іонів від молекул субстратів на коферменти НАД і НАДФ (нікотинамідаденіндинуклеотид(фосфат)). Так, алкогольдегідрогеназа печінки, яка дегідрує алкоголь з утворенням ацет- альдегіду, має два іони Zn, що зв'язують кофермент НАД з активним центром ферменту. Тому нестача цинку сприяє отруєнню організму алкоголем. Цинк входить також до складу ДНК- та іРНК-полімераз, котрі беруть участь у реплікації та транскрипції генетичної інформації. До найцікавіших функцій цинку можна віднести утворення комплексу з інсуліном і участь цинку в сприйнятті смаку та запаху рецепторами язика й порожнини носа. Вплив неорганічного іона на біохімічну реакцію може бути зумовлений також ефектом сильного електричного поля.
Нестача в організмі людини Fe приводить до анемії, оскільки іон металу входить до складу гемоглобіну крові. Зв'язок анемії з нестачею заліза був відомий давно (у XVII ст. недокрів'я лікували червоним вином, настояним на залізі). Проте надлишок заліза викликає сидероз очей і легень - хвороба, яка викликається відкладенням сполук заліза в тканинах цих органів. Деякі метали здатні оборотно окиснюватися й відновлюватися. Завдяки цій властивості Fe, Cu, Co входить до складу активних центрів багатьох ферментів, які каталізують окисно-відновні процеси. Прикладом є цитохромоксидаза, яка каталізує відновлення молекулярного кисню до води за рахунок електронів, що надходять із молекул поживних речовин. У молекулі ферменту внаслідок змін валентності залізо оборотно переходить із ферифо- рми у фероформу (Fe3+↔Fe2+). Унаслідок цього відбуваються перенесення електронів з цитохрому с на молекулярний кисень. Атоми міді в цій самій цитохромоксидазі завдяки циклічним змінам валентності також беруть участь у перенесенні електронів, акцептором яких служить кисень. З нестачею міді пов'язані суховершинність дерев і порушення координації руху - атаксія овець і великої рогатої худоби. Її нестача приводить до деструкції кровоносних судин, патологічного росту кісток, дефектів сполучної тканини. Останнє пояснюється тим, що мідь входить до складу активного центру лізилоксидази - ферменту, який за рахунок лізину "зшиває" поліпептидні ланцюги колагену. У невеликих концентраціях мідь використовується як в'яжучий і бактеріостатичний (затримує розмноження бактерій) засоби, при лікуванні кон'юнктивітів у вигляді очних капель, а також для припікання при трахомі у вигляді очних олівців (сплав Cu2+, нітрату калію, галунів і камфори), 5 % розчином сульфату міді лікують фосфорні опіки. Разом із тим, надлишок міді викликає порушення психіки і призводить до паралічу деяких органів (хвороба Вільсона). Нестача Cu та Zn є причиною недокрів'я (мідь необхідна для засвоєння заліза), а надлишок одного лише Zn у рослин викликає розеткову хворобу плодових дерев і паракератоз (потовщення шкіри) у тварин. Надлишок Sr в ґрунті викликає потворні форми рослин тощо. При зв'язуванні Са кальмодуліном - кальційзв'язувальний білок усіх клітин тварин, людини і рослин - істотно змінюється його конформація. У такій конформації кальмодулін (вірніше, комплекс білка з 1, 2, 3 і 4 атомами Са) може приєднуватись до ферментів-мішеней і, як наслідок, змінювати їхню активність.
Ферменти, активність яких залежить від наявності в їхній молекулі металів, називаються металоферментами; їх відомо більше 200. Окрім цього, мікроелементи входять до складу вітамінів (Со - В12), гормонів (І - тироксин, Zn, Co - інсулін), дихальних пігментів (Fe -гемоглобін, Сu - гемоціанін) та ін. Дія мікроелементів відбувається через вплив на обмін речовин і, як наслідок, на фізіологічні процеси. Це процеси росту (Mn, Zn, I - у тварин; B, Mn, Zn, Cu - у рослин), розмноження (Mn, Zn - у тварин, Mn, Cu, Мо - у рослин), кровотворення (Fe, Cu, Со), тканинного дихання (Cu, Zn) тощо. Ефекти одного мікроелемента часто залежать від достатнього вмісту інших. Так, поглинання бобовими рослинами молекулярного азоту перебуває під контролем Mo, Co і V. Кобальт ефективно діє на кровотворення за наявності Fe і Cu, марганець підсилює засвоєння Cu, разом з тим, мідь за деякими ефектами є антагоністом Мо, F, Sr та ін.
Лікувальні властивості притаманні й металам, які належать до шкідливих хімічних елементів. Так, давно було помічено бактерицидні. (загибель бактерій) властивості срібла і його солей. У медицині розчин колоїдного срібла (коларгол) застосовують для промивання гнійних ран, сечового міхура при хронічних циститах і уретритах та у вигляді очних крапель при гнійному кон'юнктивіті. Олівці низьких концентрацій нітрату срібла (0,10-0,25 %) використовують як в'яжучий антимікробний засіб для примочок та як очні краплі. Вважається, що випалювальна дія нітрату срібла пов'язана з його взаємодією з білками з утворенням білкових солей срібла - альбумінатів.
Отже, живі організми є досить вимогливими до певних концентрацій мікроелементів у середовищі, до набору, до форм і до їхніх співвідношень. Нестача чи надлишок мікроелементів у ґрунтах і воді однаково шкідливі для розвитку організмів, оскільки викликають ендемічні захворювання рослин, тварин і людини. Мінеральні речовини та неорганічні іони, як і вітаміни, часто діють не тільки як носії зарядів, а й подібно до вітамінів, як ко- ферменти при каталізі хімічних реакцій, які безперервно відбуваються в клітині. У живих організмах іони металів містяться не лише у вільному стані, а й у вигляді координаційних сполук з біомолекулами, які виконують роль лігандів.
А. П. Виноградов увів поняття про біогеохімічні провінції - це "області Землі, у межах яких у організмів спостерігається біологічна реакція на певний рівень вмісту хімічних елементів у довкіллі". Численними дослідженнями встановлено, що в окремих районах Землі встановлені відхилення у фізіолого-біохімічних реакціях, які викликані або нестачею, або надлишком хімічних елементів для даного виду чи популяції за рахунок природних або антропогенних факторів. Наприклад, ендемічний зоб із давніх часів зв'язують з недостатнім надходженням йоду з поживними речовинами, оскільки він міцно зв'язаний у ґрунті з гуміновими речовинами. Дія кобальту, марганцю, свинцю та інших елементів може послаблювати засвоєння йоду, або сприяти цьому. При дефіциті фтору та молібдену в ґрунтах і воді розвиваються карієс зубів у людини, при надлишку - флюороз. При надлишковому надходженні молібдену з харчами (у районах рудних корисних копалин) люди хворіють ендемічною подагрою, або молібденовим токсикозом, тощо.
Медико-біологічні дослідження свідчать, що не тільки ендемічні захворювання мають територіальні принципи поширення. Територіально обмеженими є атеросклероз, шлунково-кишкові, серцево-судинні та ендокринні хвороби, цукровий діабет, хвороби суглобів. Із неінфекційних хвороб найчастіше зв'язують з хімічним складом окремих об'єктів чи компонентів біосфери уролітіаз (сечокам'яна хвороба); із серцево-судинних хвороб - атеро- та кардіосклерози, рідше - ішемічну хворобу серця; із шлунково- кишкових - коліти й виразки; із хвороб печінки - холецистити тощо. Причин цього три: нестача, надлишок і дисбаланс хімічних елементів у всьому біогеохімічному ланцюзі.
У розвитку серцево-судинних захворювань беруть участь хром, кобальт, мідь, йод, марганець, молібден, нікель, ванадій і цинк. Найвища смертність від цих хвороб спостерігається при загальному дефіциті мікроелементів, що пов'язують з підзолистими ґрунтами. Надлишки хрому, кобальту, нікелю, цинку, кадмію у ґрунтах, воді й харчових продуктах підвищують частоту ураження населення раком шлунка і стравоходу. Рак легень пов'язують з проживанням на слабокислих ґрунтах, збіднених на залізо, кобальт і нікель. Якщо при нестачі цинку розвивається карликовість, затримується статеве дозрівання, уражуються шкіра, слизові оболонки, виникають дерматити, облисіння, то при його надлишку розвиваються анемії. Нестача літію сприяє маніакально-депресивним психозам, шизофреніям, іншим психічним захворюванням. Узагалі, чим незадовільніші біогеохімічні параметри довкілля, включаючи й радіаційний фон, тим раніше виявляється певна хвороба людини і тим важчий її перебіг.
Ґрунти є середовищем локалізації мікроорганізмів, у тому числі бактерій і цвілевих грибів, вірусів. Рівні вмісту хімічних елементів у ґрунтах можуть впливати на особливості життєдіяльності збудників інфекцій або на умови існування носіїв і переносників. Так, є дані про роль біогеохімічних факторів у природній осередковості чуми, кліщового енцефаліту. Осередки сказу серед тварин пов'язують з ґрунтами зі зниженим вмістом титану, нікелю і цирконію. І навпаки, на ґрунтах з високим вмістом титану активуються осередки сибірської виразки. Лептоспіроз у тварин найчастіше реєструється на ґрунтах з дефіцитом усіх мікроелементів, окрім титану й цирконію. Це означає, що особливості мікроелементного складу ґрунтів можна використовувати для індикації ділянок з потенційно підвищеною осередковістю інфекцій.
Отже, активність біологічних систем залежить від наявності в системі неорганічних іонів. Вони необхідні насамперед для регуляції активності ферментів, у тому числі окисно-відновних. До складу активних центрів таких ферментів входять метали, які здатні оборотно окиснюватися і відновлюватися. Важливе значення має також здатність іонів металів впливати на орієнтацію ділянок макромолекул, що приводить до змін їхньої конформації. Усі свої функції іони металів виконують, перебуваючи як у вільному стані, так і у вигляді координаційних сполук з біомолекулами, які виконують роль лігандів.