БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 15. ІНТЕГРАЦІЯ МЕТАБОЛІЧНИХ ШЛЯХІВ. ГОРМОНИ
15.4.Механізми дії гормонів
15.4.1.Механізми дії пептидних гормонів і катехоламінів
Передача інформації через мембранні рецептори включає такі етапи: взаємодія рецептора з молекулою гормону (первинним посередником), утворення комплексу гормон-рецептор, активація мембранного ферменту, що каталізує утворення вторинного посередника, активація такими посередниками специфічних білків, які впливають на перебіг внутрішньоклітинних процесів. Вторинними посередниками можуть бути молекули цАМФ, цГМФ, ІФ3, ДАГ, Са2+, NO.
За своєю будовою рецептори до пептидних гормонів є білками, переважно глікопротеїнами, і можуть складатися з різної кількості субодиниць. Взаємодія гормонів з рецептором приводить до активації внутрішньоклітинних регуляторних систем. Ділянка рецептора, що відповідає за впізнавання гормону, розташована на зовнішній поверхні мембрани, а ділянка, яка відповідає за спряження рецептора з ефекторною системою, міститься всередині мембрани. За останні десятиріччя вдалося локалізувати та клонувати гени майже всіх відомих гормонів і факторів росту, їхніх рецепторів і окремих структурних ланок пострецепторних сигнальних механізмів.
Найбільш вивченим є аденілатциклазний шлях передачі гормонального сигналу (рис. 15.6, А), за якого гормони діють через трикомпонентну систему, що включає білок-рецептор,0-білок і фермент аденілатциклазу. Субстратом для аденілатциклази слугує АТФ, з якої утворюється цАМФ, що є найважливішим внутрішньоклітинним посередником у передачі гормонального сигналу. Аденілатциклазний комплекс активується багатьма пептид- ними гормонами, а також катехоламінами.
Відомо близько 200 різних G-білків, які є гетерополімерами, що складаються із 3 субодиниць: α, β і γ. α-Субодиниця має специфічні центри зв'язування ГТФ і ГДФ, забезпечує взаємодію з рецептором та з ферментом аденілатциклазою. Неактивна форма G-білка
- комплекс αβγ-ГДФ, активація якого відбувається при взаємодії з комплексом гормон-рецептор. Утворення комплексу гормон- рецептор призводить до конформаційних змін α-субодиниці, заміні ГДФ на ГТФ, відокремленню димеру βγ. Розрізняють два типи α-субодиниць - αs і αі. Якщо рецептор спряжений з Gs-білком, то аденілатциклазу активує субодиниця αs-ГТФ, а якщо з Gi-білком - її інгібує субодиниця α1-ГТФ. Рецептор, зв'язаний з гормоном, може активувати велику кількість молекул G-білка, забезпечуючи таким чином посилення зовнішнього сигналу.
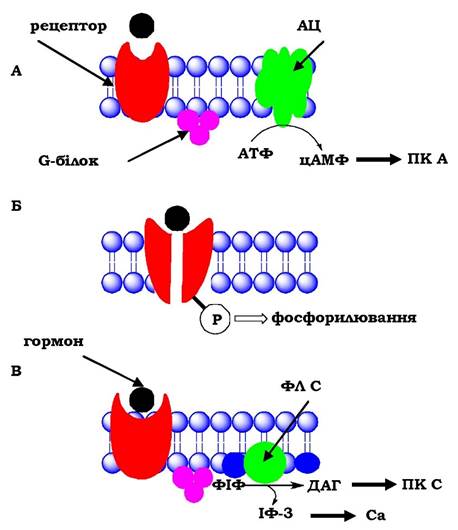
Рис. 15.6. Передача гормональних сигналів через мембранні рецептори: ПК А - протеїнкіназа А,
ПК С - протеїнкіназа С, ФІФ - фосфатидилінозитолдифосфат, ІФ-3 - інозитолтрифосфат, ДАГ — діацилгліцерол
Наступним етапом є дефосфорилювання ГТФ, зв'язаного з α-суб- одиницею, та повернення G-білка до неактивної форми - αβγ-ГДФ.
Аденілатциклаза - ключовий фермент системи, який знайдено в клітинах усіх типів, належить до інтегральних білків клітинної мембрани, містить 12 трансмембранних доменів. Зовнішні клітинні домени глікозилювані, цитоплазматичні домени мають два каталітичні центри, що відповідають за утворення цАМФ. Циклічний АМФ регулює активності ферменту протеїнкінази А.
Протеїнкіназа А складається з чотирьох субодиниць - двох регуляторних (R) і двох каталітичних (C). Комплекс R2C2 не має каталітичної активності. У результаті приєднання цАМФ до регуляторних субодиниць, які мають специфічні центри зв'язування цАМФ, відбувається дисоціація комплексу:
![]()
Субодиниця С - активна форма протеїнкінази А, яка каталізує фосфорилювання специфічних білків за залишками серину та треоніну. Така модифікація білків приводить до зміни їхньої конформації та активності, що й регулює швидкість і направленість певних процесів у клітині.
Gsa опосередковує передачу сигналів паратгормону (ПТГ), лютеї- нізуючого гормону (ЛГ), фолікулостимулюючого гормону (ФСГ), антидіуретичного гормону (АДГ), кортикотропіну (АКТГ), глюкагону.
Передача сигналів від багатьох рецепторів, спряжених з G-білками, відбувається за допомогою інозитол-1,4,5-трифосфату (ІФ3) і 1,2-діацилгліцеролу (ДАГ), які утворюються при гідролізі мембранних фосфоліпідів (рис. 15.6, В) Інозитолфосфатна система включає три основні мембранні білки: рецептор, фосфоліпазу С, G-білок. Активація фосфоліпази С, що відбувається внаслідок приєднання гормону до рецептора, приводить до гідролізу фосфатидилінозитолів клітинної мембрани з утворенням інозитолтрифосфату (ІФ3), який виходить у цитозоль, і діацилгліцеролу (ДАГ), який залишається у мембрані й бере участь у активації протеїнкінази С. ІФ3 зв'язується зі специфічними центрами на мембрані ендоплазматичного ретикулума й відкриває тим самим Са2+-канали. Концентрація іонів кальцію в цитозолі збільшується, що приводить до збільшення швидкості його взаємодії цитозоль- ною протеїнкіназою С та білком кальмодуліном. Транслокація протеїнкінази до мембрани дозволяє ферменту зв'язатися з ДАГ.
Протеїнкіназа С складається з двох доменів - регуляторного й каталітичного. Регуляторний домен має високу спорідненість до Са2+. Активна форма протеїнкінази С фосфорилює білки за залишками серину та треоніну.
Інший шлях - аутофосфорилювання рецептора за залишками тирозину (тирозинкіназна активність рецептора) і фосфорилюван- ня тирозинових залишків внутрішньоклітинних білкових субстратів (рис. 15.6, Б). За допомогою такого механізму на клітинні мішені діють інсулін, інсуліноподібний фактор росту І (ІФР-І) тощо.
Прикладом рецепторної тирозинової протеїнкінази слугує рецептор інсуліну. Рецептор складається з двох а- і двох β-субодиниць, які є глікопротеїнами, зв'язаними між собою дисульфідними зв'язками. α-Субодиниці містяться на зовнішній поверхні мембрани, у них є центр зв'язування інсуліну, а β-субодиниці проходять через мембрану. За зв'язування з інсуліном відповідає α-субодиниця, а каталітичний центр розташований на β-субодиниці. Приєднання гормону до центру зв'язування зумовлює активацію протеїнкінази, субстратом якої служить сам фермент. Відбувається аутофосфорилювання β-субодиниці за тирозиновими залишками, що приводить до активації ферменту та зміни специфічності. Протеїнкіназа починає фосфорилювати внутрішньоклітинні білки, змінюючи їхню активність. Ключовим білком, що фосфорилюється тирозиновою протеїнкіназою, є субстрат інсулінового рецептора (IRS-1), який у фосфорилюваному стані може активувати білки, необхідні, наприклад, для регуляції клітинних процесів.
Існує також система, котра генерує цГМФ як вторинний посередник. Утворення цГМФ із ГТФ каталізує фермент гуанілатциклаза, що присутня в клітині як у цитозолі, так і в мембранозв'язаному стані. Цитозольна форма ферменту складається з двох субодиниць і містить простетичну групу - гем. Мембранозв'язана гуанілатциклаза - це глікопротеїн, зовнішньоклітинний домен якого є рецептором, а внутрішньоклітинний виявляє ферментативну активність. Молекули цГМФ можуть активувати іонні канали або активувати протеїнкіназу G. Сигнальною молекулою може бути також оксид азоту NO, який утворюється з аргініну. Реакцію каталізує NO-синтаза, яка присутня в нервовій тканині, ендотелії судин, тромбоцитах. У клітинах мішенях NO взаємодіє з активним центром гуанілатциклази, прискорюючи утворення цГМФ з ГТФ.