БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 16. ЕНЕРГЕТИЧНИЙ ОБМІН
16.3.Завершальний етап катаболізму — основне джерело донорів водню для ЛПЕ
16.3.1.Окисне декарбоксилювання пірувату
Окисне декарбоксилювання пірувату (див. підрозділ 12.1.3) відбувається в матриксі мітохондрій. Транспорт пірувату в мітохондріальний матрикс крізь внутрішню мембрану мітохондрій здійснюється за участю спеціального білка-переносника за механізмом симпорту з Н+ (рис. 16.14). Перетворення пірувату в ацетил-КоА описують таким сумарним рівнянням:
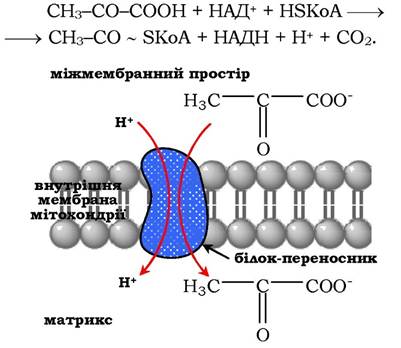
Рис. 16.14. Транспорт пірувату крізь мітохондріальну мембрану
У ході цієї реакції відбувається окисне декарбоксилювання пірувату, у результаті якого карбоксильна група від'єднується у вигляді CO2, а ацетильна група включається до складу ацетил- КоА. Один атом водню потрапляє у склад НАДН, а інший у вигляді Н+ надходить у середовище. Реакція необоротна, оскільки ∆G0 = -33,5 кДж/моль.
Будова піруватдегідрогеназного комплексу. Процес окисного декарбоксилювання каталізує складнорганізований піруватдегідрогеназний комплекс (ПДК). У ПДК входять три ферменти: піруватдекарбоксилаза (Е1), дигідроліпоїлтрансацетилаза (Е2) та дигідроліпоїлдегідрогеназа (Е3), а також п'ять коферментів: тіа- міндифосфат (ТДФ), ліпоєва кислота (ЛК), ФАД, НАД+ і КоА. Крім того, до складу комплексу входять регуляторні субодиниці: про- теїнкіназа та фосфопротеїнфосфатаза (табл. 16.4).
Усі ці ферменти й коферменти об'єднані в мультиферментну систему, яка містить різну кількість кожного з ферментів і має молекулярну масу більше 6 ·106Да.
У центрі комплексу розміщується дигідроліпоїлтрансацетилаза (Е2), яка утворює його ядро. До дигідроліпоїлтрансацетилази приєднані молекули піруватдекарбоксилази (Е1) і дигідроліпоїлдегідрогенази (Е3).
Таблиця 16.4
Піруватдегідрогеназний комплекс ссавців
Фермент |
Кількість мономерів |
Кофер мент |
Вітамін |
|
Піруватдекарбоксилаза |
Е1 |
120 (30 тетрамерів) |
ТДФ |
B1 |
Дегідроліпоїл- трансацетилаза |
Е2 |
180 (60 тетрамерів) |
ліпоамід КоА |
ліпоєва кислота пантотенова кислота |
Дигідроліпоїлдегідрогеназа |
Е3 |
12 (6 димерів) |
ФАД НАД+ |
В2 РР |
Піруватдекарбоксилаза містить міцно зв'язаний з білковою частиною ТДФ, а дигідроліпоїлдегідрогеназа - ФАД.
Ліпоїлізовані групи центрального ферменту (Е2) функціонують як поворотні "кронштейни", які переносять атоми водню й ацетильні групи від однієї ферментної молекули комплексу до іншої.
Реакції, що каталізуються ПДК. Перетворення пірувату в ацетил-КоА включає п'ять стадій (рис. 16.15).
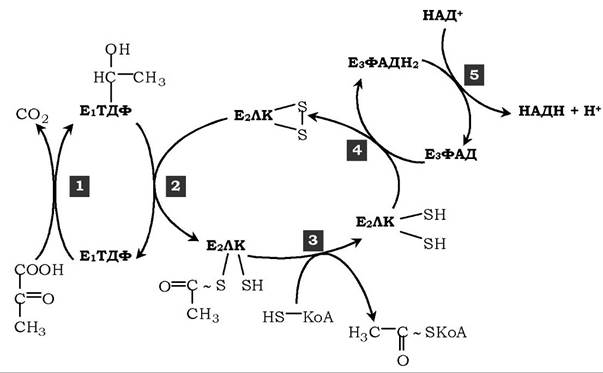
Рис. 16.15. Послідовність реакцій, що каталізуються піруватдегідрогеназним комплексом:
1 — Е1 каталізує декарбоксилювання пірувату й перенесення С2-фрагмента на ТДФ; 2 - Е2 каталізує окиснення гідроксіетильної групи й перенесення С2-фрагмента на ЛК; 3 - ацетильована дигідроліпоїлтрансацетилаза взаємодіє з КоА з утворенням відновленої форми ліпоєвої кислоти й ацетил-КоА;
4 - окиснена форма трансацетилази регенерується за участю Е3;
5 - окиснена форма Ез регенерується за участю НАД+
На першій стадії піруват з'єднується з ТДФ у складі Еі і піддається декарбоксилюванню:
![]()
У результаті цієї реакції утвориться похідна ТДФ з гідроксіетильною групою при тіазоловому кільці (рис. 16.16).
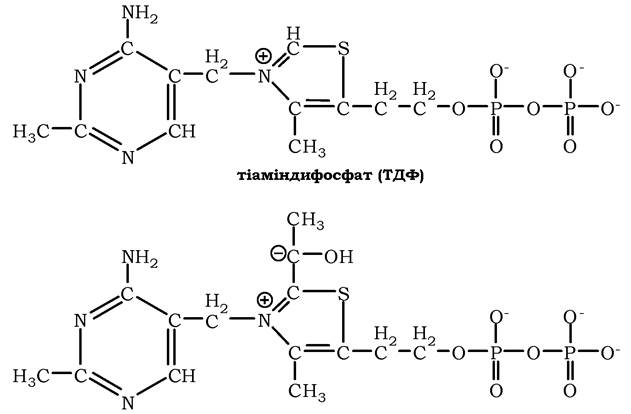
Рис. 16.16. Тіаміндифосфат і гідроксіетилфосфат-ТДФ:
Робочою частиною ТДФ є тіазолове кільце, до якого приєднується продукт декарбоксилювання пірувату — гідроксіетил
Друга стадія: дигідроліпоїлтрансацетилаза (Е2) каталізує перенесення атома водню й ацетильної групи від ТДФ на окиснену форму ліпоїллізинових груп з утворенням ацетилтіоефіру ліпоєвої кислоти (рис. 16.15).
На третій стадії КоА взаємодіє з ацетильною похідною Е2, у результаті чого утворюються ацетил-КоА і цілком відновлений ліпоїльний залишок, простетична група Е2.
На четвертій стадії дигідроліпоїлдегідрогеназа (Е3) каталізує перенесення атомів водню від відновлених ліпоїльних груп на ФАД - простетичну групу ферменту Ез.
На п'ятій стадії відновлений ФАДН2 передає водень на НАД+ з утворенням НАДН.
Піруватдегідрогеназний комплекс характеризується великим негативним окисно-відновним потенціалом, що забезпечує поряд з відновленням коферменту (НАДН) утворення високоенергетичного тіоефірного зв'язку в ацетил-КоА.
Структурне об'єднання трьох видів ферментів створює можливості для координації окремих етапів складної ферментативної реакції. Усі проміжні продукти реакції окисного декарбоксилювання пірувату міцно зв'язані з комплексом, що збільшує сумарну швидкість процесу та зводить до мінімуму побічні реакції.
Піруватдегідрогеназний комплекс, як і всі білки, що беруть участь у реакціях ЦТК, кодується ядерною ДНК. Транспорт субодиниць ПДК у мітохондрії відбувається складним шляхом за рахунок енергії АТФ або трансмембранного електрохімічного потенціалу за участю білків теплового шоку, або шаперонів, які запобігають їхньому передчасному фолдингу до надходження в мітохондріальний матрикс або внутрішню мембрану мітохондрій.
Зв'язок окисного декарбоксилювання пірувату з ЛПЕ. Окисне декарбоксилювання пірувату супроводжується утворенням НАДН, що постачає електрони в дихальний ланцюг і забезпечує синтез 3 моль АТФ на 1 моль пірувату шляхом окисного фосфорилювання.
Оскільки співвідношення АДФ/АТФ і НАДН/НАД+ у клітині відносно постійне, прискорення утилізації АТФ приводить до підвищення концентрації АДФ і прискорення окиснення НАДН у дихальному ланцюгу. Підвищення концентрації НАД+, у свою чергу, стимулює окисне декарбоксилювання пірувату. Навпаки, підвищення концентрації АТФ і НАДН знижує швидкість цього процесу. Отже, зміни співвідношень АДФ/АТФ і НАДН/НАД+ є найважливішими сигналами, що відображають енергетичні потреби клітини й регулюють швидкість окисного декарбоксилювання пірувату. Каталітична активність піруватдегідрогеназного комплексу знижується, коли в клітинах є достатньо "палива" у вигляді жирних кислот і ацетил-КоА.