БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 4. МОЛЕКУЛЯРНА ОРГАНІЗАЦІЯ І БІОЛОГІЧНІ ФУНКЦІЇ МЕМБРАН
4.3. Функції мембран
4.3.2. Пори, канали та електрогенез
Пори в біологічних мембранах утворюються білками й ліпідами. Білкові пори, заповнені водою, найчастіше зустрічаються в зовнішніх мембранах бактерій та мітохондрій і утворені з білка порину та подібних до нього білків. У плазматичних мембранах тваринних клітин пори мають ліпідну природу. Пороподібну структуру мають і щілинні контакти між клітинами. Ці структури (пори) різні за розмірами і неспецифічні до речовин, які через них проникають. Навпаки, білкові канали мають менші, ніж білкові пори, розміри і служать в основному для специфічного транспорту іонів. Їх називають іонними каналами.
Порини утворюють пори, які функціонують як молекулярні сита, що забезпечують дифузію невеликих (до 600 Да) молекул через мембрану (рис. 4.14). Відомо понад 40 поринів з м. м. 28-48 кДа. Їхньою основною особливістю є те, що вони утворюють трансмембранний канал: β-ланцюги утворюють β-циліндр, внутрішні стінки якого утворені полярними зарядженими амінокислотними залишками. Поринові пори дуже різні за розмірами (0,6-23 нм), їхні тримери утворюють три незалежні канали (рис. 4.14, А) або один великий канал, а "матриксний порин" з E. coli має три входи із зовнішнього боку плазматичної мембрани, які потім зливаються, утворюючи один вихід у периплазму. Порини зовнішньої мембрани мітохондрій також утворюють циліндричну структуру з β-структурних елементів, який є потенціалозалежним аніонсе- лективним каналом.
Як і в будь-якому кристалі, у фосфоліпідному бішарі виникають різноманітні дефекти, серед яких важливим є дефект типу ліпідної гідрофільної пори (рис. 4.14, Б). Як видно з рисунка, пора має два радіуси: d/2 і r. На межі пори діють дві протилежні сили: одна - крайовий лінійний натяг периметра пори (d/2) сприяє росту пори, а друга - поверхневий натяг бішару (r) викликає стискування пори. Нестійкий стан мембрани буде при критичному значенні радіуса - r*: при r > r* - мембрана розривається, при r < r* - пора "затікає", мембрана залишається стабільною (самозаліковується). Критичний радіус ліпідних пор в мембрані в рідинно-кристалічному стані досягає 9 нм.
Оскільки мембранний потенціал спокою (див. далі) не перевищує 0,1 В (у мітохондрій - 0,2 В), а товщина мембрани не перевищує 10 нм, напруженість електричного поля на мембрані сягає 10 7 В/м. Мембрана є досконалішим електричним ізолятором, ніж багато технічних ізоляторів. Тому електричний пробій власним МПС малоймовірний. Але МПС може зростати в результаті дії зовнішнього електричного поля й перевищувати порогові значення МПС для електричного пробою. Результатом останнього і є утворення ліпідних пор. Це явище використовується й у біотехнології: для збільшення пористості мембрани (електропорація), уведення в клітину ДНК (електротрансфекція), звільнення клітини від великих молекул (електропермеабілізація), злиття клітин (електрозлиття), а також для пояснення факту гемолізу еритроцитів у кріобіології.
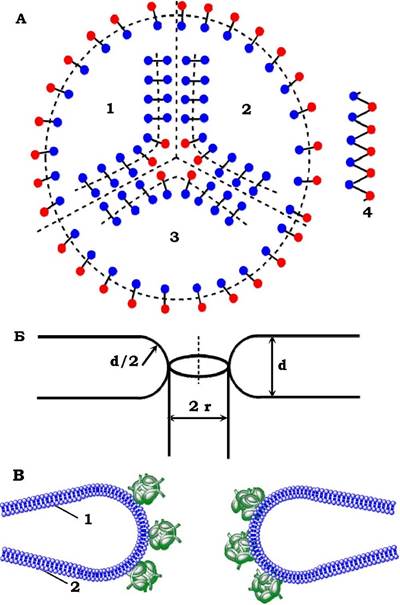
Рис. 4.14. Схема мембранних гідрофільних йор:
А - із порину (вигляд зверху): 1, 2, 3 - три незалежні канали, утворені тримером порину;
4 - β-ланцюг порину з гідрофільними (сині) і гідрофобними (червоні) амінокислотними залишками.
Б - із ліпідів (у розрізі): d - товщина ліпідного бішару; d/2 - радіус кривизни стінки; r- радіус пори.
В - поперечний розріз ядерної пори з водним каналом діаметром 9 нм; 1 - зовнішня і 2 - внутрішня ядерні мембрани
Таким чином, стабільність мембрани залежить від кількості й розмірів ліпідних пор, які утворюються в місцях дефектів рідинно-кристалічної структури ліпідного бішару. Ліпідні пори виникають у результаті теплових флуктуацій, а також можуть утворюватись при будь-яких механічних, фізичних чи хімічних впливах, які є факторами ризику в стабілізації мембран. Для мембрани стабільність у таких випадках буде залежати від того, буде чи не буде ліпідна пора перевищувати критичні розміри. У першому випадку мембрана розірветься, у другому - її структура збережеться.
У всіх еукаріотів, від дріжджів до людини, ядерна оболонка утворена двома мембранами: внутрішньою і зовнішньою. Внутрішня ядерна мембрана має специфічні білки, які зв'язують ядерні ламіни. Ця мембрана оточена зовнішньою ядерною мембраною, яка переходить у ендоплазматичний ретикулум. Ядерна оболонка пронизана ядерними порами, оточеними поровими комплексами. Поровий комплекс (набір білків) пронизує ядерну оболонку, зв'язуючи по колу пори ліпідний бішар обох мембран у єдине ціле (рис. 4.14, В). Діаметр пори становить 9 нм (що відповідає критичному діаметру ліпідних пор), довжина - 15 нм. Через такі пори в ядро (як і з ядра) вільно проникають малі молекули й білки з м. м. 44-45 кДа. Інші білки, як і нуклеїнові кислоти, перетинають ядерні пори активним шляхом.
Аналогічна білкова природа і щілинних контактів - кластерів мембранних каналів, які з'єднують вміст сусідніх клітин у тканинах. Діаметр таких пор становить від 1,2 до 2 нм. Біохімічна реконструкція цих пор свідчить про те, що вони утворені олігомером єдиного білка (наприклад, для гепатоцитів вона становить 32 кДа). Кожний щілинний контакт складається з 12 субодиниць, по шість від кожної плазматичної мембрани.
Іонні канали забезпечують перенесення за електрохімічним градієнтом ~ 106 іонів за секунду (що значно перевищує швидкість транспорту відомими білками-переносниками). Головним чином, це іони Na+ , K+, Ca2+ і СI-. Білковим каналам притаманна іонна селективність, тобто через них проходять лише іони одного типу. Це означає, що кожний іон повинен мати відповідний заряд і розміри. Іонні канали відрізняються від пор ще й тим, що вони відкриті не постійно. У них є ворота (рис. 4.15), які відкриваються на короткий час, а потім закриваються. Ворота відкриваються у відповідь на зміни мембранного потенціалу спокою (потенціалозалежні канали), на механічні стимули (механочутливі канали) або на зв'язування окремих сигнальних молекул (хімічно чутливі чи лігандозалежні канали). Сигнальними молекулами є нейротрансміттери (нейромедіатори), нуклеотиди. Уже відомо понад 50 типів іонних каналів, відповідальних за електричну збудливість нервових і м'язових клітин, передачу електричних сигналів по збудливим тканинам і клітинам, вони присутні в усіх клітинах тварин і в деяких клітинах рослин і мікроорганізмів. Найпоширенішими є калієві канали, які створюють мембранний потенціал спокою і Na+ - та Са2+-канали, котрі беруть участь у генерації потенціалів дії.
Біоелектричні потенціали дуже різноманітні й відрізняються головним чином за двома параметрами: амплітудою і частотою. Так, розряд електричних риб, який створюється певною кількістю клітин, сягає 800 В, чого достатньо, щоб убити дрібну тварину. У той же час, біопотенціали мозку (електроенцефалограма) становить мікровольти. За частотою коливань біопотенціали варіюють від годин (поверхня шкіри) до кількох мілісекунд (нервові імпульси у хребетних). Електрична активність, незалежно від іонів, які беруть участь у її генерації, поділяється на два типи:
✵ мембранний потенціал спокою (МПС), тобто різниця потенціалів між двома боками мембрани, що залежить в основному від різниці в концентраціях іонів K+ ;
✵ потенціали дії (ПД) - зміни МПС у процесах збудження клітин, зумовлені зміною в проникності мембрани до іонів натрію і кальцію.
Найлегше через мембрану в стані спокою проникають іони калію. Вони виходять із клітини за градієнтом концентрації. При цьому всередині клітини залишаються аніони, що є причиною виникнення електричного поля - мембранний потенціал, який намагається повернути іони калію у клітину. Вихід іонів калію зупиниться, як тільки мембранний потенціал (утворення якого є наслідком виходу калію) досягне значення, при якому електрична рушійна сила, що "втягує" іони калію, зрівняється з дією градієнта концентрації калію, який виштовхує ці іони з клітини, тобто коли електрохімічний потенціал μ = 0. Стан мембрани при цьому характеризується відсутністю трансмембранного електричного струму, настає рівновага, а потенціал на мембрані називається рівноважним калієвим потенціалом Такий потенціал визначається за рівнянням Нернста:
![]()
де Vk - рівноважний калієвий потенціал ("мінус" усередині клітини), Со і Сі - зовнішня і внутрішня концентрація іона; R - універсальна газова постійна (2 кал · моль-1, K); Т - абсолютна температура, K; F - число (постійна) Фарадея (2,3 · 104 кал · В-1 · моль-1) і Z - заряд іона.
Оскільки інші іони також проникають через мембрану в стані спокою (хоч їхня проникність значно менша), то МПС за величиною буде меншим від калієвого рівноважного потенціалу. Наприклад, розрахований Vк для аксона кальмара становить -90 мВ, а виміряний експериментально -60 мВ. Це є результатом проникнення в основному іонів натрію в напрямку, протилежному проникненню іонів калію.
Окрім пасивного транспорту іонів, генерація різниці потенціалів на мембрані пов'язана також із їхнім активним механізмом транспорту (рис. 4.12). Оскільки натрієво-калієвий насос є електрогенним, то блокування Na+, K+ -АТФази приведе до зниження МПС. Важливо, що, незважаючи на розмаїття живих об'єктів, існують дві електрогенні транспортні АТФази: у тварин - Na+ , K+ -АТФаза, у рослин і грибів - Н+ -АТФаза. Постійна активність цих мембранних ферментів забезпечує постійну підзарядку мембрани - створює активну компоненту МПС зі знаком "мінус" усередині.
Уперше механізми збудження були вивчені на гігантському аксоні кальмара: вони не покриті мієліновою оболонкою, мають діаметр до 1 мм, що полегшує проведення експериментів. При збудженні нервового волокна збільшується проникність плазматичної мембрани для іонів Na+ (потік направлений усередину клітини, оскільки їх більше зовні), що викликає зменшення МПС - деполяризацію мембрани (рис. 4.15). Виникає висхідна гілка потенціалу дії. Процес деполяризації мембрани іонами натрію продовжується до встановлення нового рівноважного стану, після чого різко підвищується проникність мембрани для K+. Оскільки іонів калію більше всередині клітини, вони виходять із неї й реполяризують мембрану до вихідного значення МПС.
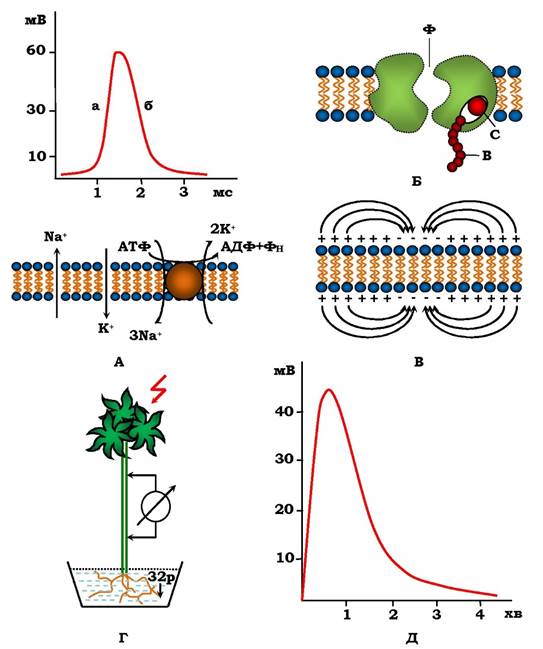
Рис. 4.15. Схема генерації та поширення ПД у нервовому волокні (А-В); ПД, який виникає при подразненні листка рослини й поширюється по провідних пучках до коріння (Г, Д): А - ПД нервового волокна, Б - схема будови іонного каналу (Ф - селективний фільтр, В - ворота, С - сенсор, чутливий до напруги на мембрані); В - поширення ПД по збудливій мембрані: "-" - збуджені, "+" - незбуджені ділянки мембрани; стрілками показано напрямок локальних струмів;
Г - активація (подразненням листків світлом) усмоктування 32Р корінням рослини, Д - ПД рослин
Зміна в часі проникності мембрани в процесі збудження пояснюється особливостями функціонування натрієвих і калієвих каналів (рис. 4.15, Б), які мають селективний "фільтр" і "ворота". Селективний фільтр згідно фізико-хімічним властивостям "відбирає" іони. Ворота є частиною каналу, конформаційний стан якого залежить від мембранного потенціалу. Вони можуть приймати кілька альтернативних конформацій, стабільність яких залежить від величини електричного поля. Початкова деполяризація мембрани відкриває ворота натрієвих каналів і виникає вхідний натрієвий потік (крива а, рис. 4.15, А). Подальша деполяризація не тільки закриває ворота натрієвого каналу, а й відкриває калієві канали, що приводить до виникнення вихідного потоку іонів калію і, як наслідок, до реполяризації мембрани (низхідна крива б на рис. 4.15, А). Таку властивість іонні канали набули в процесі еволюції. При збудженні між незбудженими (двома) і збудженою (однією) ділянками мембрани протікають локальні струми (рис. 4.15, В), які:
✵ реполяризують збуджену ділянку, котра відповідає низхідній лінії ПД і підвищенню калієвої провідності мембрани (рис. 4.15; А);
✵ деполяризують мембрану попереду збудженої ділянки (яка генерує ПД у даний час), і коли деполяризація досягає порогового рівня - виникає ПД. Це відповідає висхідній лінії ПД (рис. 4.15, А) і забезпечує його поширення в одному напрямку;
✵ деполяризація ділянки після ПД не викликає збудження мембрани, оскільки іонні канали, передусім натрієвий, ще не встигли відновитися: натрієвий канал інактивований - це стан рефрактерності.
Механізм генерації ПД для всіх організмів однаковий, хоча є й істотні відмінності. Так, деполяризуючий іон у нервових волокнах - Na+, у клітинах гладких м'язів - Ca2+ , у рослинних клітинах — Сl-.
Роль біоелектричних потенціалів у процесах життєдіяльності вельми універсальна та різноманітна. По-перше, це енергетична роль. МПС, який створюється активними й пасивними механізмами, за аналогією з АТФ, може розглядатися, як своєрідна форма запасання енергії в клітині, тобто критерієм "енергізованості" клітини є не тільки кількість у ній макроергів, а й величина її мембранного потенціалу. Особливо важливо, що електрична енергія мембрани "висококонвертована", тобто може легко переходити в інші форми енергії, необхідної для конкретних біологічних процесів. Особливо це стосується мембранного транспорту, який забезпечує субстратами обмін речовин.
По-друге, біоелектричні потенціали відіграють регуляторну роль. Напруженість електричного поля (105 В/см) дуже впливає на окремі складові мембрани - білки й ліпіди, молекули яких мають електричні заряди й дипольні моменти. Такі молекули за дії електричного поля змінюють свою орієнтацію та конформаційний стан. Тому зміни МПС і ПД за дії різноманітних факторів впливають на роботу мембранних білків-ферментів, рецепторів, каналів, пор, переносників тощо.
По-третє, істотною є інформаційна роль біоелектричних процесів, яка найдосконаліше представлена в нервових волокнах. ПД, що виникають у них за впливу різних стимулів, поширюються зі швидкістю 100 м/ с і забезпечують передачу інформації від однієї частини організму до іншої. Аналогічні процеси відбуваються і в рослин.
По-четверте, біоелектричні потенціали мають важливе значення й для самоорганізації живих систем. Електричні поля навколо клітин і тканин є силовою матрицею, згідно з якою відбувається ріст і розвиток окремих органів організму.