БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 4. МОЛЕКУЛЯРНА ОРГАНІЗАЦІЯ І БІОЛОГІЧНІ ФУНКЦІЇ МЕМБРАН
4.4. Злиття мембран при екзо- та ендоцитозі
Розглянуті механізми пасивного й первинного та вторинного активного транспорту не здатні транспортувати макромолекули. Важливою особливістю як екзоцитозу, так і ендоцитозу є транслокація макромолекул, які секретуються або поглинаються в мембранних пухирцях. Такі пухирці можуть зливатися тільки зі специфічними мембранами, що забезпечує направлене перенесення речовин. Типи й цитологічні аспекти екзо- та ендоцитозу розглядаються в курсі "Цитологія", тому зупинимось на біохімічних і фізико- хімічних механізмах злиття мембран. Ці процеси важливі тому, що вони спостерігаються при кожному акті екзо- та ендоцитозу, при поділі клітин і мітохондрій, заплідненні, утворенні багатоядерних клітин, при диференціюванні, при інфікуванні "мембранними" вірусами. Штучно викликане злиття мембран широко використовується при виконанні різних біотехнологічних і біомедичних завдань. Оскільки екзо- й ендоцитоз - це близькі процеси, то розглянемо механізм злиття на прикладі тучних клітин. Ці клітини та їхні секреторні гранули (з гістаміном, гепарином і серотоніном) настільки великі, що за допомогою електронного мікроскопа вдається зафіксувати весь хід екзоцитозу.
Як видно зі схеми (рис. 4.20), у вихідному стані секреторні гранули розташовані далеко від плазматичної мембрани. У від повідь на зовнішній стимул гранула переходить у прямий контакт з плазматичною мембраною. У зоні контакту плазматична мембрана вигинається в бік мембрани гранули, утворюючи димпл, вершина якого дуже викривлена. Ділянка такого контакту становить ~10 нм. Саме тут і відбувається утворення пори злиття, яка забезпечує вихід секрету із гранули в позаклітинний простір, тобто злиття - це об'єднання мембран з утворенням пори. Стінки таких пор утворені сильно вигнутими ліпідними бішарами. Навколо пори розміщені білкові макромолекулярні структури, до складу яких входить актин. Припускається, що ці структури сприяють утворенню димплів.
Пора відкривається (утворюється) стрибком, радіус її становить 0,2 нм. Вона то відкривається, то закривається, і в певний час діаметр її починає швидко зростати. За цей час площа мембрани гранули помітно збільшується за рахунок перенесення ~ 105 ліпідних молекул із плазматичної мембрани, тобто стінки самих пор вистелені ліпідами. Рухомою силою ліпідного потоку є різниця поверхневого натягу плазматичної та гранулярної мембран. А основна роль в утворенні локального натягу належить білкам, які часто називають білками злиття мембран.
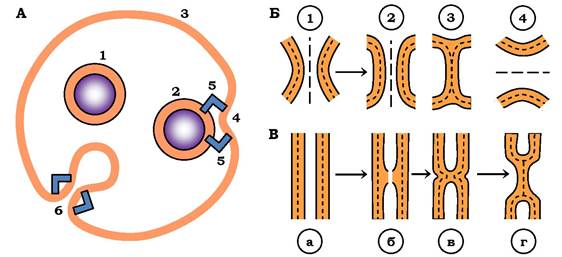
Рис. 4.20. Схеми процесів екзоцитозу (А), злиття двох плоских БЛМ (Б) і виникнення сталка (В).
А: 1 - секреторна гранула, 2 - контакт мембрани гранули і плазматичної мембрани, 3 - плазматична мембрана, 4 - димпл
(вигин ПМ у бік гранули), 5 - білки злиття, 6 - пора злиття. Б - послідовність проміжних стадій злиття двох БЛМ (1-4; пояснення в тексті). В - схема виникнення і розвитку сталка (а-г; пояснення в тексті)
При дослідженні пласких бімолекулярних ліпідних мембран вдалося установити віддаль між мембранами, за якої відбувається їх злиття. Наближення таких двох мембран одна до одної (через перепад гідростатичного тиску) приводить до поступового зменшення товщини водної плівки між ними аж до встановлення рівноважного плоскопаралельного контакту (рис. 4.20; 2). Такий стан метастабільний, тобто через певний період часу здійснюється самовільний перехід стану 2 у стан 3. На цій стадії два бішари зливаються в один. Цей процес дістав назву »напівзлиття»: мембрани об'єднались за рахунок злиття тільки зовнішніх моношарів, а водні об'єми залишились роз'єднаними. Стан 3 досить стійкий і подальші процеси злиття проходять лише в тому разі, якщо діють фактори злиття, до яких належить і електричне поле. За дії такого поля злиття мембран завершується (стан 4), тобто тепер об'єднані і мембрани, і розчини.
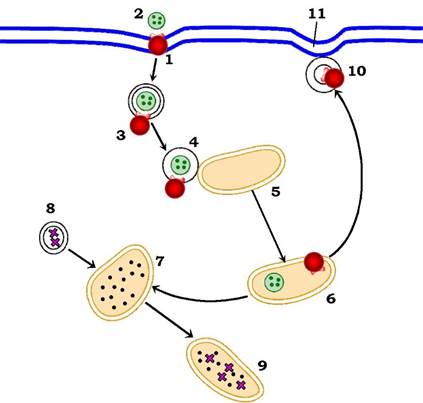
Рис. 4.21. Схема ендоцитозу ліпопротеїнів низької густини (ЛНГ):
1 - рецептор до ЛНГ у плазматичній мембрані (відповідає білкам злиття на рис. 5.20); 2 - ЛНГ; 3 - ендоцитозний пухирець (клатринова оболонка пухирця не показано); 4 - злиття з ендосомою (вигин ендосоми в бік пухирця відповідає димплу на рис. 5.20); 5 - ендосома; 6 - периферична ендосома з дисоційованим рецептором до ЛНГ (причиною дисоціації є кисле середовище); 7 - перинуклеарна ендосома, яка зливається з транспортним пухирцем (8) із апарату Гольджі (* - фермент), утворює ендолізосому (9); 10 - транспортний пухирець, від'єднаний від периферичної ендосоми, з рецептором до ЛНГ;
11 - вигин (димпл) плазматичної мембрани
Стан напівзлиття енергетично вигідний, оскільки перехід зі стану 2 у стан 3 (рис. 4.20) зменшує сумарну поверхню системи; замість двох бішарів отримується один. Під впливом теплових флуктуацій відбуваються локальні деформації згину, у результаті утворюються збурення (спучування) - вони експонують у розчин гідрофобні хвости ліпідних молекул. Притягання таких гідрофобних місць на сусідніх мембранах (рис. 4.20, Б, а) зумовлює формування між ними перемички (б, в) яку назвали сталком (stalk - стебло). Останньому притаманна висока енергія, оскільки її ліпідний бішар, що його формує, дуже вигнутий. Розширення сталка, що супроводжується злиттям віддалених моношарів (протилежних моношарам, де утворюється сталк), приводить до утворення контактного бішару (рис. 4.20, г).
Отже, злиття біологічних мембран, у тому числі при екзо- та ендоцитозі (рис. 4.20) - це багатостадійний процес за участю білків і ліпідів. Білки (у першу чергу рецептори) забезпечують локальний контакт двох мембран злиття. Білки злиття створюють додатковий натяг (чи згинаючий момент) у контактних бішарах, розрив яких приводить до утворення пори злиття.
Солюбілізація і реконструкція мембран. Дослідження мембран базується на двох основних методичних прийомах: розбирання мембрани на складові й наступне повне (чи часткове) відновлення її структури. Ці два прийоми мають свої назви - солюбілізація і реконструкція мембран.
Перші спроби солюбілізації мембран були зроблені в 60-ті роки XX ст. Використовувались методи механічного руйнування, дії ультразвуку, використання органічних розчинників, які тепер називаються неадекватними методами. І лише після введення детергентів у практику мембранних досліджень вдалось розкрити основні секрети структури й функції мембран.
Детергенти (лат. detergere - мити, очищати) - це поверхнево- активні речовини, які утворюють у воді стійкі колоїдні розчини й адсорбуються на межі розділу фаз "вода - повітря», "вода - масло", що зумовлено амфіфільністю їхніх молекул. У воді такі речовини утворюють міцели, до складу яких входять до сотні молекул, орієнтованих таким чином, що їхні неполярні групи формують внутрішнє гідрофобне ядро, а гідрофільні полярні групи - контактують з молекулами води. Саме завдяки наявності гідрофобного ядра міцели детергентів здатні солюбілізувати мембрани - переводити в розчин речовини, які практично нерозчинні у воді.
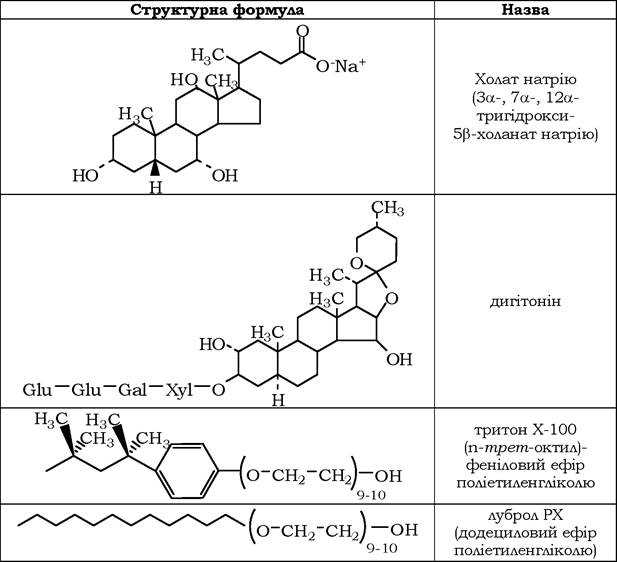
Відомо кілька сотень різних детергентів двох класів (табл. 4.5): іонні та неіонні. Іонні детергенти поділяються на катіонні, аніонні та цвітер-іонні (у останніх є і позитивний, і негативний заряди, тому загалом молекула є електрично нейтральною). Основними параметрами, які характеризують здатність детергентів до міцелоутворення, є критична концентрація міцелоутворення (ККМ) і число агрегації. ККМ - найменша концентрація детергенту, при якій утворюються міцели. Число агрегації показує, скільки молекул припадає на одну міцелу. Для детергентів, які найчастіше використовуються для солюбілізації мембран, притаманні високі значення ККМ (10-4-10-2 моль/л) і те, що вони належать до "м'яких" детергентів, які не порушують активність мембранних ферментів і не викликають значної денатурації мембранних білків.
Таблиця 4.5
Приклади детергентів, які найчастіше використовуються для солюбілізації та реконструкції мембран
Мембранні білки й ліпіди також є амфіфільними молекулами. Але ККМ для них становить 10«10 -10-9 моль/л, у воді ці молекули не розчиняються, а агрегують. Тому в присутності детергентів і ліпідів мембран виникає "конфлікт": детергент "хоче" набути міцелярної конфігурації, а ліпід "хоче" зберегти бішарову упаковку. Коли детергенту мало, то він лише утворює дефекти в упаковці ліпідів з утворенням пор. При зростанні концентрації детергенту дефект у ліпідному бішарі підсилюється. Коли концентрація детергенту в мембрані досягає ККМ, мембрана руйнується з утворенням змішаних ліпід- детергентних і білок-детергентних міцел, які фактично є розчином компонентів мембран у надлишку детергенту (рис. 4.22). Це і є момент солюбілізації. У солюбілізованому стані мембранні білки легко відділити від основної маси ліпідів, після чого виділити мембранні білки. Для цього використовують методи гель-фільтрації, хроматографії та електрофорезу у водному буфері тощо.
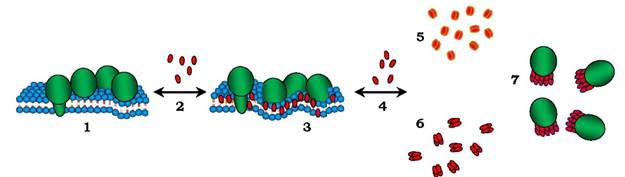
Рис. 4.22. Солюбідізація мембран за допомогою детергентів:
1 - мембрана, 2 - додавання детергенту; 3 - часткова фрагментація мембрани; 4 - додавання детергенту в концентрації більшій за ККМ; 6 - міцели із детергенту.Додавання детергенту приводить до руйнування мембрани з утворенням змішаних детергентно-ліпідних (5) і детергентно-білкових (7) міцел. Стрілками вліво показано зниження концентрації детергенту, що приводить до відновлення мембрани
Реконструкцію мембран проводять за тими самими принципами, що й солюбілізацію. Якщо концентрацію детергенту у змішаних міцелах зменшити, то міцелярні агрегати перетворюються на мембрани (рис. 4.22). Найчастіше користуються чотирма способами видалення детергенту, а саме: діаліз, гель-фільтрацію, розбавлення солюбілізату, адсорбцію детергенту на гідрофобних полімерах. Оскільки молекули детергентів порівняно малі (табл. 4.6), вони вільно проходять через пори діалізної мембрани і їхня концентрація знижується. Цей спосіб хороший для детергентів з високою ККМ (холат натрію). Неіонні детергенти типу тритону-100 при діалізі видаляються не повністю, крім того, цей метод занадто тривалий. При гель-фільтрації солюбілізат пропускають через інертний гель, розмір пор якого достатньо великий, щоб затримати молекули детергенту, але малий порівняно з мембранними частками, які вільно проходять між гранулами гелю. Ще швидше можна реконструювати мембрану методом швидкого розбавлення. Для цього солюбілізат розводять великим об'ємом середовища (без детергенту), вміст детергенту в міцелах різко падає і мембрана реконструюється.
За допомогою цих та інших методів виділено майже всі мембранні білки, що дозволило встановити молекулярні механізми їхнього функціонування, міжмолекулярні взаємодії в мембранах, відтворити функції енергетичного забезпечення клітини, транспорту метаболітів, рецепції та передачі інформації тощо. Знання принципів реконструкції дає можливість зрозуміти, як саме відбувається біогенез мембран і як створити мембранні системи для їхнього практичного застосування, наприклад, для направленої доставки ліків тощо.
Отже, клітинні мембрани - це складні надмолекулярні структури. Їхні молекулярні комплекси утворюють упорядковану рідинно-кристалічну мозаїку, що й забезпечує мембранам біологічну специфічність. Взаємодіючи зі стимулами різної природи, мембрани трансформують їхню енергію в енергію біологічного збудження клітини. Це і є початком процесів, які забезпечують часово-просторову організацію біохімічних, фізико-хімічних і фізичних процесів у надзвичайно обмеженому об'ємі, яким є клітина. Тому молекулярна організація клітинних мембран є одним з актуальних напрямів у дослідженнях сучасної біохімії.