БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.1. Будова та властивості амінокислот, які входять до складу білків. Пептидні зв’язки
5.1.4. Пептидний зв'язок. Будова та біологічні властивості пептидів
α-Амінокислоти можуть ковалентно зв'язуватися одна з одною за допомогою пептидних зв'язків. Такий зв'язок утворюється між α-карбоксильною групою однієї амінокислоти та α-аміногрупою іншої, тобто він є амідним зв'язком. Унаслідок цього відбувається відщеплення молекули води:
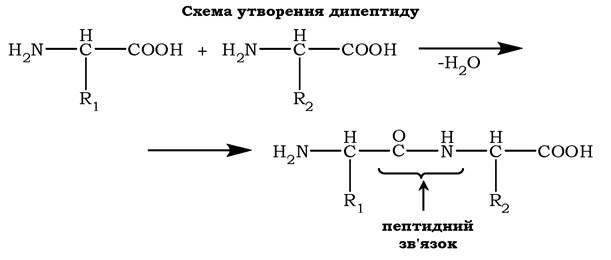
Будова пептиду. Кількість амінокислот у пептиді може сильно варіювати. Пептиди, що містять до 10 амінокислот, називають олігопептидами. Часто в назві таких молекул вказують кількість амінокислот, що входять до складу олігопептиду: трипептид, пентапептид, октапептид та інші.
Пептиди, що містять понад 10 амінокислот, називають поліпептидами, а такі, що складаються з більш ніж 50 амінокислотних залишків, зазвичай називають білками. Проте ці назви умовні, оскільки в літературі термін "білок" часто використовують для позначення поліпептиду, який містить менше 50 амінокислотних залишків. Наприклад, гормон глюкагон, що складається з 29 амінокислот, називають білковим гормоном.
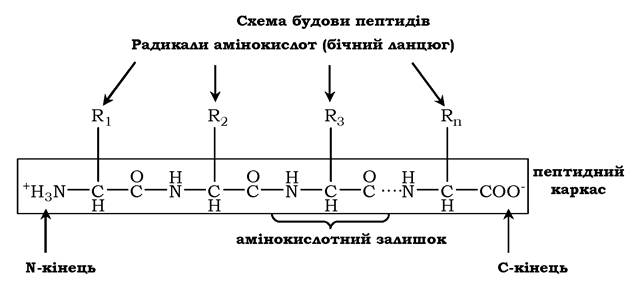
Мономери амінокислот, що входять до складу білків, називають амінокислотними залишками. Амінокислотний залишок, який має вільну аміногрупу, називається N-кінцевим і пишеться зліва, а той, що має вільну α-карбоксильну групу, - С-кінцевим і пишеться справа. Пептиди пишуться й читаються з N-кінця. Зв'язок повторюваних атомів у поліпептидному ланцюзі -NH-CH-CO- називається пептидним каркасом:
Для назви поліпептиду до скороченої назви амінокислотних залишків додають суфікс -іл, за винятком С-кінцевої амінокислоти. Так, тетрапептид Сер-Глі-Про-Ала читається як серилглі- цилпролілаланін:
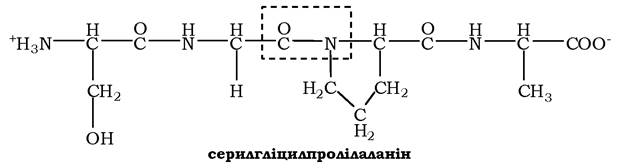
Пептидний зв'язок, утворюваний іміногрупою проліну, відрізняється від інших пептидних зв'язків, оскільки атом азоту пеп- тидної групи зв'язаний не з воднем, а з радикалом.
Пептиди різняться за амінокислотним складом, кількістю та порядком сполучення амінокислот. Сер-Гіс-Про-Ала і Ала-Про- Гіс-Сер - два різні пептиди, незважаючи на те, що вони мають однаковий кількісний і якісний склад амінокислот.
Характеристика пептидного зв'язку. Пептидний зв'язок має характеристики частково подвійного зв'язку, тому він коротший, ніж інші зв'язки пептидного каркасу, через що є менш рухливим. Електронна будова пептидного зв'язку визначає пласку жорстку структуру пептидної групи. Площини пептидних груп розміщені під кутом одна відносно одної (рис. 5.1).
Зв'язок між α-вуглецевим атомом і α-аміно- або а-карбоксильною групою здатен до вільних обертань (хоча вони обмежені розміром і характером радикалів), що дозволяє пептидному ланцюгу набувати різних конфігурацій.
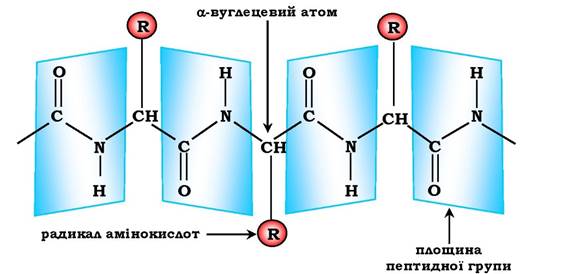
Рис. 5.1. Площини розміщення пептидних груп і α-вуглецевих атомів у просторі
Пептидні зв'язки зазвичай знаходяться у трансконфігурації, тобто α-вуглецеві атоми розташовуються по різні боки від пептидного зв'язку. У результаті бокові радикали амінокислот розміщуються на найвіддаленішій відстані один від одного у просторі (рис. 5.2).
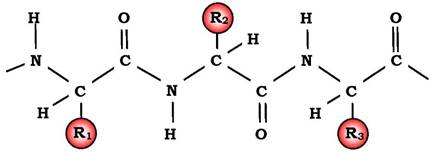
Рис. 5.2. Трансконфігурація пептидних зв'язків.
Функціональні групи -СО- і -NH-, які утворюють пептидні зв'язки, не іонізовані, але полярні, і можуть брати участь у створені водневих зв'язків.
Пептидні зв'язки дуже міцні й самочинно не розриваються за нормальних умов, що існують у клітині (нейтральне середовище, температура тіла). У лабораторних умовах гідроліз пептидних зв'язків у білках проводять у запаяній ампулі з концентрованою (6 моль/л) соляною кислотою, при температурі більше 105 °С. Повний гідроліз білка до вільних амінокислот відбувається приблизно за добу.
У живих організмах пептидні зв'язки в білках розриваються за допомогою протеолітичних ферментів (від англ. protein - білок, lysis - руйнування), які називаються протеазами, або пептидгідролазами.
Для виявлення в розчині білків і пептидів, а також для їхнього кількісного визначення використовують біуретову реакцію (позитивний результат для речовин, що містять у своєму складі не менше двох пептидних зв'язків).
Біологічна роль пептидів. В організмі людини виробляється велика кількість пептидів, що бере участь у регуляції різноманітних біологічних процесів і має високу фізіологічну активністю.
Кількість амінокислотних залишків у структурі біологічно активних пептидів може варіювати від 3 до 50. Одним із "найменших" пептидів є тиреотропін-рилізинг-гормон і глутатіон (трипептиди), а також енкефаліни, котрі мають у своєму складі 5 амінокислот. Однак більшість біологічно активних пептидів має у складі понад 10 амінокислот. Наприклад, нейропептид Y (регулятор апетиту) містить 36 амінокислот, а кортиколіберин - 41. Деякі з пептидів, зокрема більшість пептидних гормонів, містять пептидні зв'язки, утворені α-аміногрупою та а-карбоксильною групою сусідніх амінокислот. Як правило, вони синтезуються з неактивних білкових попередників, у яких специфічні протеолітичні ферменти розщеплюють певні пептидні зв'язки.
Ангіотензин ІІ - октапептид, що утворюється з білка плазми крові ангіотензиногену в результаті послідовної дії двох протеолітичних ферментів. Перший протеолітичний фермент ренін відщеплює від ангіотензиногену з N-кінця пептид, який містить 10 амінокислот і називається ангіотензином І. Другий протеолітичний фермент карбоксидипептидилпептидаза відщеплює від С-кінця ангіотензину І дві амінокислоти, у результаті утворюється біологічно активний ангіотензин ІІ, який бере участь у регуляції артеріального тиску (АТ) і водно-сольового обміну в організмі:

У певних біологічно активних пептидах можуть міститися або незвичні амінокислоти, або існують незвичні зв'язки між амінокислотами, які не зустрічаються в білках. Прикладом пептиду із вмістом незвичного для білків зв'язку між амінокислотами є три- пептид глутатіон, побудований із цистеїну, глутамату і гліцину:
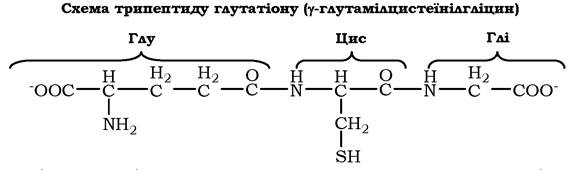
N-кінцева амінокислота глутамат зв'язана з другою амінокислотою цистеїном не через α-карбоксильну групу, а через γ-кар- боксильну групу його радикала. Глутатіон - поширений пептид в організмі людини. Він може використовуватися в окисно- відновних реакціях як донор і акцептор водню й необхідний для роботи ряду ферментів.
Функції пептидів залежать від їхньої первинної структури. Ангіотензин І за структурою дуже схожий на ангіотензин ІІ (має лише дві додаткові амінокислоти на С-кінці), але при цьому він біологічно неактивний.
Зміни в амінокислотному складі пептидів часто приводять до втрати одних і появи інших біологічних властивостей. Як приклад можна розглянути структуру та властивості двох пептидних гормонів - окситоцину й вазопресину. У гіпоталамусі окситоцин і вазопресин утворюються в результаті часткового (обмеженого) протеолізу білкових попередників. Із гіпоталамуса по нервових волокнах ці гормони всередині секреторних гранул переміщуються в нервові закінчення аксонів, розташованих у задній частці гіпофіза. Після дії специфічних стимулів ці гормони виділяються у кров:
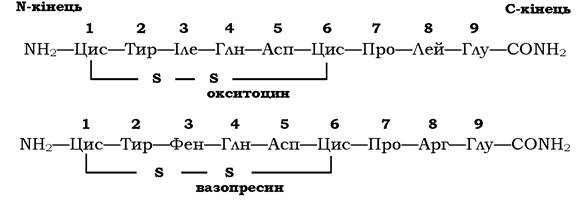
Окситоцин і вазопресин мають у своїй структурі багато спільного:
✵ обидва містять дев'ять амінокислотних залишків;
✵ сім амінокислотних залишків із дев'яти ідентичні;
✵ два залишки цистеїну сполучені дисульфідним зв'язком;
✵ на С-кінці пептидів α-карбоксильна група глутамату є амідованою.
Незважаючи на невеликі відмінності в послідовності амінокислот (заміни амінокислот у положеннях 3 і 8), ці гормони сильно відрізняються своєю фізіологічною дією. Так, окситоцин виділяється у кров під час годування дитини, викликає скорочення мі- оепітеліальних клітин протоків молочних залоз і стимулює виділення молока. Крім того, окситоцин впливає на гладеньку мускулатуру матки під час пологів, викликаючи її скорочення.
На відміну від окситоцину, основною фізіологічною дією вазопресину є збільшення реабсорбції води в нирках при зменшенні АТ чи об'єму крові (тому друга назва цього гормону - антидіуретичний). Крім того, вазопресин викликає звуження гла- деньком'язових клітин (ГМК) судин.
Варто відмітити, що наявність у положенні 8 основної амінокислоти є важливою для прояву антидіуретичної активності, а амінокислоти з гідрофобним радикалом у положенні 3 - для скорочення ГМК.
Оскільки пептиди - це потужні регулятори біологічних процесів, їх можна розглядати як лікарські препарати. Основною перешкодою для терапевтичного використання пептидів є швидке руйнування їх в організмі.
Одним із найважливіших результатів досліджень є не тільки вивчення структури пептидів, але й отримання синтетичних аналогів природних пептидів з цільовими змінами в їхній структурі й функціях. Наприклад, синтезовано пептид І-дезаміно-8-D- аргінін-вазопресин (ДАВ), структуру якого зображено на схемі:
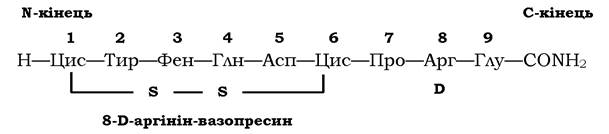
У структурі цього пептиду (порівняно з вазопресином) нема аміногрупи на N-кінці, і замість L-аргініну в положенні 8 міститься D-аргінін. Такий синтетичний пептид володіє тільки антидіуретичною активністю, він хімічно стійкий, тобто при введенні в організм викликає тривалу реакцію. Порівняно з природним такий штучний аналог гормону є ефективнішим при лікуванні гормональної недостатності.
За основною фізіологічною дією пептиди можна поділити на:
✵ гормонально активні (окситоцин, вазопресин, рилізинг- гормони гіпоталамуса, меланоцитстимулюючий гормон, глюкагон тощо);
✵ що регулюють процеси травлення (гастрин, холецистокінін, ва- зоінтестинальний пептид, шлунковий інгібуючий пептид та ін.);
✵ що регулюють тонус судин і АТ (брадикінін, калідин, ангіотензин ІІ);
✵ що регулюють апетит (лептин, нейропептид Y, меланоцитстимулюючий гормон, β-ендорфіни);
✵ мають знеболювальну дію (енкефаліни і ендорфіни та інші опіоїдні пептиди). Ефект знеболення при застосуванні цих пептидів у сотні разів перевищує анальгезуючий ефект морфіну;
✵ беруть участь у регуляції вищої нервової діяльності, біохімічних процесах, пов'язаних з механізмами сну, навчання, пам'яті, виникнення почуття страху тощо.
Проте такий поділ пептидів дуже умовний. З'явилися дані про те, що багато пептидів мають широкий спектр дії. Так, меланоцитстимулюючий гормон, крім стимуляції пігментоутворення, бере участь у регуляції апетиту (разом із лептином пригнічує почуття голоду, є антагоністом нейропептиду Y). Разом з тим, β-ендорфіни, крім анальгезуючого ефекту, є синергістами нейропептиду Y, тобто посилюють почуття голоду. Описаний вище вазопресин, крім антидіуретичної та судинозвужувальної дії, має властивість поліпшувати пам'ять.