БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 1. БУДОВА Й РЕАКЦІЙНА ЗДАТНІСТЬ БІООРГАНІЧНИХ СПОЛУК
1.1. Молекули як складові живих організмів
1.1.1. Енантіомери й хіральні сполуки
Коли в молекулі атом вуглецю зв'язаний із чотирма різними функціональними групами (або атомами), то цей атом є асиметричним, а молекула може існувати у двох ізомерних формах - енантіомерах. Їх називають також оптичними ізомерами (стереоізомерами), здатними повертати (ліворуч чи праворуч) площину поляризації плоскополяризованого світла, хоч у хімічних реакціях поводять себе однаково. Сполуки з асиметричним атомом назвали хіральними сполуками (грец. chiros - рука), а сам асиметричний атом називають хіральним атомом і позначають зірочкою - С*. Характерно, що в організмах хіральні молекули присутні лише в одній зі своїх стеріоізомерних форм. І це тому, що хіральні біомолекули синтезуються за участю ферментів, які теж мають хіральну структуру.
Ізомери мають однаковий хімічний склад, але відрізняються за фізико-хімічними властивостями. Вони різняться молекулярною структурою - порядком зв'язування атомів у молекулі чи просторовим розташуванням груп. Розрізняють ізомерію будови (структурна ізомерія) і стереоізомерію (просторову ізомерію). У першому випадку ізомери ланцюга мають відміни в послідовності сполучення атомів у лінійному ланцюзі. Наприклад, н-бутан (н - нормальний) має структурну формулу СН3-СН2-СН2-СН3, а ізобутан — СН3-СН(СН3)-СН3. До цього ж типу ізомерії відносять ізомери положення, в яких різні положення однакових функціональних груп або подвійних зв'язків. Наприклад, 1-бромпропан (СН3-СН2-СН2-Вr) і 2-бромбутан (СН3-СНBr-СН3). Бутен-1 (СН2=СН-СН2-СН3) від бутен-2 (СН3-СН=СН-СН3) відрізняється положенням подвійного зв'язку. До структурної ізомерії належать і ізомери функціональних груп - молекули мають однаковий атомний склад, але різні функціональні групи. Так, молекулярна формула С2Н6О відповідає й етиловому спирту (СН3-СН2-ОН), і диметиловому ефіру (СН3-О-СН3). Окремою групою структурних ізомерів є таутомери, які часто спостерігаються серед біологічно важливих сполук. При таутомеризації існує рівновага між ізомерами. Скажімо, ацетальдегід існує в кето- й енольних формах: СН3-СНО ↔ СН2=СН-ОН.
Стереоізомери відрізняються розташуванням груп атомів. Для цього потрібно розмежовувати поняття конформації та конфігурації. Під конфігурацією молекули розуміють певне розміщення ковалентно зв'язаних атомів. Конформація визначається орієнтацією груп атомів, зумовленою обертанням їх навколо одинарних зв'язків. Тому конфігураційні ізомери не здатні до взаємоперетворення без розриву хімічних зв'язків, існують як індивідуальні молекули. Конформ.аційні ізомери утворюються шляхом обертання атомів С навколо ковалентних простих (одинарних) σ-зв'язків. Ці зв'язки утворюються в результаті перекривання орбіталей атомів упродовж осі, яка з'єднує два атоми. Перекривання атомних орбіталей здійснюється так, що електронна густина зосереджується впродовж умовної лінії, яка проходить через центри двох атомів («осьове» перекривання). На відміну від σ-зв'язків, ковалентні π-зв'язки утворюються при бічному перекриванні атомарних орбіталей, перпендикулярному до власних осей двох орбіталей. Тому π-зв'язок є двома хмарами максимальної електронної густини, які локалізуються по обидва боки від σ-зв'язку (рис. 1.1; А). Одинарні зв'язки утворюються за рахунок σ-зв'язків, подвійні складаються з одного σ- та одного π-зв'язків, а потрійні - з одного σ- і двох π-зв'язків.
Серед конфігураційних ізомерів розрізняють оптичні та геометричні ізомери. Залежно від розташування груп, оптичні ізомери поділяють на енантіомери (дзеркальні ізомери) і діастереомери. Енантіомери як хіральні сполуки є оптичними антиподами (дзеркальними ізомерами). Діастереоізомери не є дзеркальними антиподами. У них не один, а кілька хіральних атомів С (наприклад, моносахариди), тому виникає багато стереоізомерів.
Для встановлення конфігурації оптично активних ізомерів їх порівнюють із найпростішим із цукрів - гліцеральдегідом. Обидва його стереоізомери позначають буквами L і D. Порівнюючи з енантіомерами гліцеральдегіду, скажімо, аланін (рис. 1.1), можна встановити L- і D-форму останнього. За пропозицією Е. Фішера, амінокислота міститься в L-конфігурації, якщо її аміногрупа розташована ліворуч, і в D-конфігурації, якщо ця сама група виявляється праворуч. Е. Фішер запропонував для зручності зображати формули речовин, указуючи всі зв'язки звичайними лініями - проекційна формула Фішера. Побудову цих формул здійснюють за такими правилами:
✵ вуглецевий ланцюг молекули записують вертикально;
✵ зверху розташовують найбільш окислений атом вуглецю;
✵ замісники, які локалізовані над площиною, розміщують горизонтально, а ті, що під площиною - вертикально.
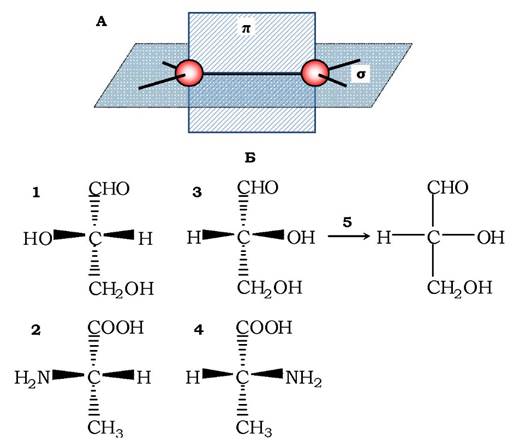
Рис. 1.1. Схема розміщення площин σ- і π-зв'язків у молекулі вуглеводнів (А) і відповідність між структурою енантіомерів гліцеральдегіду та аланіну (Б): 1, 2 - L-форми гліцеральдегіду та аланіну; 3, 4 - D-форми цих самих сполук. Щоб зобразити тривимірну молекулу на площині, зв'язки, які направлені від площини рисунка до читача, зображені чорними трикутниками (клинами), а зв'язки, які йдуть за площину рисунка - пунктирними трикутниками; 5 - перехід від стереохімічної формули до проекційної формули Фішера
На рис. 1.1, 5 показано перехід від стереохімічної формули (див. далі) до проекційної, з якої видно, що гліцериновий альдегід має найбільш окиснений атом С зверху, групи Н і ОН, які спрямовані до читача, записані горизонтально, а групи, локалізовані за площиною (СНО і СН2ОН) - вертикально. Окрім такого різновиду стереоформул та їхніх проекцій, існують стереохімічні, перспективні й проекційні формули Ньюмена. У стереохімічних формулах зв'язки, розташовані в площині паперу, подаються звичайними рисками, зв'язки ближче до спостерігача - жирними клинами, а зв'язки під площиною - штриховими клинами (рис. 1.1).
Для характеристики конформаційних ізомерів найчастіше застосовують перспективні формули і проекційні формули Ньюмена. При зображенні конформерів за допомогою перспективних формул зв'язок С-С є таким, що лівий вуглець є ближчим до читача, а правий - віддалений (рис. 1.2, 1, 3). При зображенні перспективними формулами стереоізомерів етану, які утворюються за рахунок обертання СН3-груп навколо одинарного σ-зв'язку, виникають заслонена й загальмована конформації. У проекційних формулах Ньюмена спостерігач розглядає молекулу вздовж зв'язку С-С. Ближчий до читача вуглець розташовується на перетині трьох прямих, а віддалений атом вуглецю позначається колом, до якого приєднуються групи (рис. 1.2, 2, 4). У заслоненій конформації етану атоми Н сусідніх СН3-груп просторово найбільш зближені (максимально відштовхуються), тому такі конформації термодинамічно нестійкі. У загальмованих конформаціях сили відштовхування зменшуються, повертання навколо зв'язків ніби гальмується. Тому така система є найстійкішою. Енергетичний бар'єр переходу, наприклад етану із загальмованої конформації до заслоненої, становить ~13 кДж. Завдяки обертанню СН3-груп навколо σ-зв'язку С-С молекула етану набуває багато конформацій, що відрізняються величиною кута φ (рис. 1.2, 4, 5), що вказує на взаємну орієнтацію СН3-груп.
Навіть найпростіші молекули мають якусь одну (переважну) конформацію. Обертання навколо осі будуть ускладнюватися зі зростанням величини груп. Так, в етану (де відповідними групами атомів є Н) обертальний бар'єр досягає ~13 кДж/моль. Коли це групи метильні, він становить 25 кДж/моль. Через це в багатьох біологічних молекулах ланцюги з СН2-груп намагаються набути повністю витягнутої конформації - антиконформації, як, скажімо, у жирних кислотах. Також часто зустрічаються дві скошені конформації (гош-конформації), такі ж стійкі, як і попередня (рис. 1.2, 5, 6). Наприклад, у молекулі н-бутану при повному обертанні (360°) навколо С-С-зв'язку виникає шість конформацій, які відрізняються на 60°: три заслонені, одна - загальмована та дві скошені (гош) конформації. Торсійний кут φ для правих конформацій має позитивне значення, для лівих - негативне. Скошені конформації в біологічних молекулах зустрічаються часто й забезпечують мінімум стеричних перешкод, зумовлених взаємодією атомів при С-послідовностях.
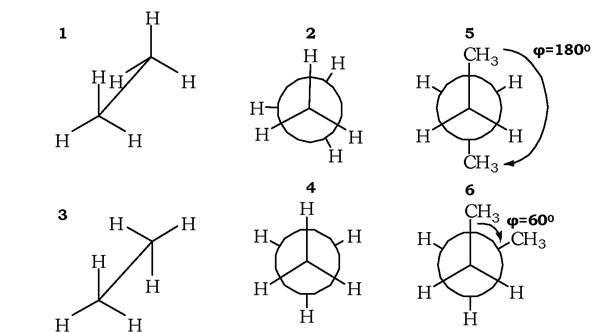
Рис. 1.2. Формули Ньюмена для зображення конформерів:
1, 3 - перспективні, 2, 4 - проекційні. Конформації етану: 1, 2 - заслонена, 3, 4 - загальмована. Конформації бутану:
5 - загальмована (анти), 6 - скошена (гош)
Геометричні ізомери виникають унаслідок різного просторового розташування атомів і груп відносно площини подвійного зв'язку або площини аліциклічного кільця. Найчастіше застосовують для позначення геометричних ізомерів цис-, транс- систему. Префікс «цис»надають геометричному ізомеру, в якого однакові замісники розташовані по один бік подвійного зв'язку (або площини циклу), а префікс «транс» - коли вони знаходяться по різні боки такого зв'язку (рис. 1.3). Усі вони мають різні фізико-хімічні властивості, а інколи - і біологічні. Так, цисізомер пропандіолової кислоти - малеїнова кислота -токсичний для вищих організмів, а транс-ізомер - фумарова кислота - є важливим інтермедіатом процесів внутрішньоклітинного окиснення. Якщо біля двох атомів С, сполучених подвійним зв'язком, є чотири різні замісники, то застосовується E-Z-система ізомерів. Як видно з рис. 1.3, 3, коли бром і хлор як замісники містяться по один бік від подвійного зв'язку, маємо Z-конфігурацію, якщо замісники розташовані протилежно - Е-конфігурацію (від нім. zusammen- разом і entgegen - навпроти).
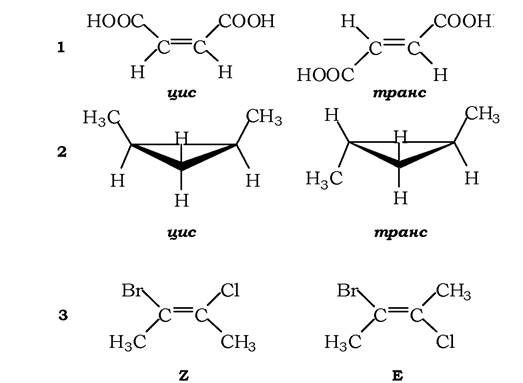
Рис. 1.3. Геометричні конфігураційні ізомери:
1 - ізомери пропандіолової кислоти (цис-ізомер є малеїновою кислотою, транс- - фумаровою); 2 - ізомери 1,2-диметилциклопропану; 3 - приклади Z- і Е-ізомерів: Z - 2-бромо-3-хлоробутен, Е - 2-бромо-3-хлоробутен
Існує і RS-система позначення оптичних ізомерів (від лат. rectus - правий; sinister - лівий). Вона є єдиним способом позначення оптичних ізомерів сполук, які або не можна зіставити з ізомерами гліцеральдегіду, або неможливо однозначно охарактеризувати в межах DL-системи. Це часто має місце, коли необхідно класифікувати складні природні сполуки, які мають більше двох хіральних центрів. Трапляється, що дві споріднені сполуки з однією конфігурацією згідно з DL-системою в RS-системі мають протилежні конфігурації. Біохімія ж має справу зі сполуками, які здебільшого за хіральністю є одноцентровими. Тому при визначенні концентрації амінокислот і вуглеводів застосовують DL-систему.
Серед нековалентних зв'язків у біології особливо важливими є водневі зв’язки та гідрофобні взаємодії. Н-зв'язки зумовлені електростатичним притяганням, що виникає через нерівномірний розподіл електронів між атомами, які беруть участь у ковалентних зв'язках. Наявність такої поляризації вказують стрілками (які заміняють зображення хімічних зв'язків) або позначають δ+ і δ-:
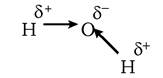
Такі молекули (з дуже поляризованими зв'язками) називають полярними на противагу неполярним (молекулам, групам), наприклад—СН3-групі, в якій електрони рівномірно розподілені між атомами вуглецю і водню. Здатність до утворення Н-зв'язків дуже характерна для молекули води (див. розд. 2). Такі зв'язки мають виражений направлений характер: найсильнішим зв'язок буває тоді, коли три атоми локалізовані на одній прямій. Зміна ентальпії (ΔН0) утворення такого зв'язку досягає 20 кДж/моль. Н-зв'язок завжди утворюється між парами груп: одна з них орієнтована щодо іншої від'ємним кінцем диполя, а друга є донором протонів.
Природу гідрофобних взаємодій зрозуміти важче, але й вони зумовлені в основному сильним взаємним притяганням молекул води. Гідрофобні взаємодії можна розглянути на прикладі переходу гідрофобної молекули з інертного розчинника (наприклад, ССІ4) у воду, виділивши два етапи.
1. У воді при цьому утворюється "порожнина" з розмірами гідрофобної молекули. Значення ΔG (зміна вільної енергії, або енергії Гіббса) утворення такої порожнини дуже високе, оскільки такий процес супроводжується розривом багатьох Н-зв'язків. Це ентальпійний ∆Н ефект.
2. Молекули води тепер повинні пристосовуватися до присутності гідрофобної молекули. Тому вони переорієнтовуються таким чином, щоб забезпечити оптимальні умови для вандерваальсових взаємодій і утворити максимальну кількість Н-зв'язків. Це приводить до обмеження рухливості молекул води, які оточують гідрофобні молекули, тобто зростає структурність води й ентальпія утворення нових Н-зв'язків майже повністю компенсується ентальпією утворення порожнини. Отже, сумарна зміна ентальпії при переході неполярних молекул з інертного розчинника у воду ~ 0. Але збільшення структурності води веде до зниження ентропії (S) - від'ємне значення ΔS. А такий перехід енергетично не вигідний, чим і пояснюється погана розчинність гідрофобних речовин у воді (підрозд. 2.2). Утворення гідрофобного "зв'язку" між двома гідрофобними молекулами у воді супроводжується руйнуванням частини Н-зв'язків води навколо кожної гідрофобної молекули, тобто супроводжується збільшенням ентропії. Тому гідрофобні взаємодії мають ентропійну природу. Проте інколи Δ8 може рівнятись нулю (або бути й від'ємною). Це спостерігається у випадку гетероциклічних сполук, які мають і гідрофобні, і гідрофільні ділянки. Структурованість води, яка оточує гетероциклічні основи, менша, ніж води, що оточує повністю неполярні молекули. Тому зміни ентальпії, які супроводжують гідрофобну асоціацію гетероциклічних молекул, можуть бути від'ємними, щоб асоціація виявилась вигідною, навіть при зниженні ентропії. Саме тому основним фактором, що визначає стабілізацію подвійної спіралі ДНК, є стосоподібне розміщення основ (стекінг). Гідрофобні взаємодії супроводжуються в даному разі зменшенням ентропії (ΔS ~ -30 Дж/ моль·град на пару основ) і зниженням ентальпії від -14 до 30 кДж/моль.
Багато простих органічних речовин існують у вигляді суміші таутомерних форм - ізомерів, які швидко переходять одна в одну. Класичним прикладом цього є кето-енольна рівновага:
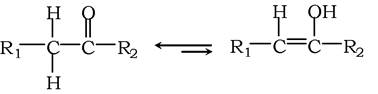
Енол легко утворюється із кето-таутомера завдяки тому, що атоми Н при атомі С, який зв'язаний з карбонільною (С=О) групою, мають кислотні властивості й дисоціюють. Як правило, легше дисоціюють протони, зв'язані з атомами кисню чи азоту, зумовлюючи існування таутомерії в амідах і "кільцях", у яких складовими є кисень і азот. Таутомерні відношення не залежать від рН, але залежать від температури, розчинника й наявності білків та інших макромолекул, з якими зв'язуються таутомери.
У деяких випадках властивості молекул неможливо описати на основі однієї валентної структури. Тоді говорять про явище резонансу - перерозподіл валентних електронів. Прикладом цього є утворення енолят-іона:
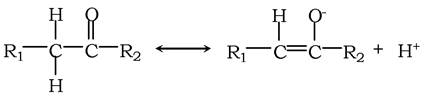
Явища резонансу й таутомерії взаємопов'язані. Наприклад, кислотні властивості Н при атомах С в кетонах, які спричиняють утворення енольних таутомерів, є прямим наслідком стабілізації енолят-аніона, який виникає при дисоціації одного із цих воднів. Порівнюючи два останні рівняння, видно їхню аналогію. Тому було прийнято, що для зображення резонансної структури перехід між відповідними формами позначають двонаправленими стрілками, а таутомерної - двома стрілками, різними за довжиною. Таутомеризація імідазольної групи важлива у функціонуванні багатьох ферментів, можливо, за рахунок вивільненого протона в ділянці його активного центру.
Оптичні ізомери повільно й самовільно неферментативно рацемізують: чистий L- чи D-ізомер перетворюється на еквімолярну суміш L- і D-ізомерів. Рацемізація (наприклад, L-амінокислоти) за постійної температури проходить з постійною швидкістю. Це використовують для визначення віку людей, тварин і викопних залишків організмів. Так, у дітей у період формування зубів у дентині є лише L-аспартат. Він самовільно рацемізує при температурі людського організму зі швидкістю 0,10 % на рік. Виділивши дентин і визначивши в ньому вміст D-аспартату, можна встановити вік людини. Ці дані добре узгоджуються з результатами, отриманими з використанням радіоактивних ізотопів.
Отже, важливими особливостями біоорганічних молекул є:
✵ утворення тривимірних структур;
✵ повертання окремих груп молекул навколо С-С-зв'язку, що забезпечує утворення різних конформацій;
✵ завдяки постійним за довжиною С-С- і С=С-зв'язкам біомолекули мають характерні й постійні розміри;
✵ тривимірні структури біомолекул забезпечують комплементарність, що сприяє взаємодії ферменту із субстратом, гормону з рецептором, реплікації ДНК тощо.
Органічні молекули, з яких побудовані клітини, умовно поділяють на малі органічні молекули й макромолекули. До перших належать сполуки, до складу яких входить до 30 атомів вуглецю (М. м. 100-1000). Вони містяться в цитозолі, використовуються для синтезу макромолекул і є проміжними продуктами в хімічних реакціях, які трансформують звільнену з поживних речовин енергію в потрібну для використання форму. Таких молекул у клітині близько 1000 і становлять вони до 10 % від усіх клітинних органічних речовин. Оскільки макромолекули побудовані з малих молекул і розпадаються на такі ж малі молекули, усі органічні малі молекули можна поділити на кілька родин. Це прості цукри, жирні кислоти, амінокислоти й нуклеотиди. Правда, деякі сполуки клітини не належать до цих родин (коферменти, деякі гормони, гормоноїди, медіатори та ін.), але на вказані чотири родини малих молекул і побудовані з них макромолекули припадає найбільша (за винятком води) частина клітинної маси (табл. 1.2).
Таблиця 1.2
Приблизний хімічний склад бактеріальної клітини
Назва речовин та іонів |
Вміст від загальної маси клітини, % |
Число типів молекул чи іонів |
Вода |
70 |
1,0 |
Моносахариди |
1,0 |
250 |
Амінокислоти |
0,4 |
100 |
Нуклеотиди |
0,4 |
100 |
Жирні кислоти |
1,0 |
50 |
Інші малі молекули |
0,2 |
300 |
Макромолекули, |
26 |
6000 |
у тому числі: - ДНК |
1 |
1 |
- РНК |
6 |
3000 |
- білки |
14 |
3000 |
- полісахариди |
3 |
5 |
- ліпіди |
2 |
20 |
Неорганічні іони |
1 |
20 |