БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.3. Формування тривимірної структури білка в клітині
5.3.2. Структура і функціональна роль шаперонів у фолдингу білка
У процесі синтезу поліпептидних ланцюгів, транспорту їх через мембрани, під час збирання олігомерних білків виникають проміжні нестабільні конформації, схильні до агрегації. На щойно синтезованому поліпептиді є багато гідрофобних радикалів, які в тривимірній структурі заховані всередині молекули. Тому на час формування нативної конформації реакційноздатні амінокислотні залишки одних білків мають бути ізольовані від таких самих груп інших білків.
У всіх відомих організмах від прокаріотів до вищих еукаріотів знайдені білки, здатні зв'язуватися з білками, які перебувають у нестійкому, здатному до агрегації стані. Вони здатні стабілізувати їхню конформацію, забезпечуючи фолдинг білка. Це - шаперони.
Відповідно до молекулярної маси всі шаперони (Ш) можна розділити на шість основних груп:
✵ високомолекулярні - з молекулярною масою від 100 до 110 кДа;
✵ Ш-90 - з молекулярною масою від 83 до 90 кДа;
✵ Ш-70 - з молекулярною масою від 66 до 78 кДа;
✵ Ш-60;
✵ Ш-40;
✵ низькомолекулярні - з молекулярною масою від 15 до 30 кДа.
Серед шаперонів розрізняють конститутивні білки (високий базальний синтез яких не залежить від стресових впливів на клітини організму) та індуцибельні, синтез яких у нормальних умовах слабкий, але під час стресових впливів на клітину він стрімко збільшується. Індуцибельні шаперони належать до білків теплового шоку, швидким синтез яких відзначають практично в усіх клітинах, які піддаються будь-яким стресовим впливам. Назва білки теплового шоку виникла в результаті того, що вперше вони були знайдені в клітинах, які піддавалися дії високої температури.
Під час синтезу білків N-кінцева ділянка поліпептиду синтезується раніше, ніж С-кінцева ділянка. Для формування конформації білка потрібна його повна амінокислотна послідовність. Тому в період синтезу білка на рибосомі захист реакційноздатних радикалів (особливо гідрофобних) здійснюють Ш-70.
Ш-70 - висококонсервативний клас білків, він присутній в усіх компартментах клітини: цитоплазмі, ядрі, ендоплазматичному ретикулумі, мітохондріях. Поблизу карбоксильного кінця єдиного поліпептидного ланцюга шаперонів є ділянка у формі борозенки, утворена радикалами амінокислот. Вона здатна взаємодіяти з ділянками білкових молекул і розгорнутих поліпептидних ланцюгів довжиною в 7-9 амінокислотних залишків, збагачених гідрофобними радикалами. В амінокислотному ланцюзі, який перебуває в процесі синтезу, такі ділянки зустрічаються приблизно через кожні 16 амінокислот.
Фолдинг багатьох високомолекулярних білків, що мають складну конформацію (наприклад, доменну будову), здійснюється у спеціальному просторі, сформованому Ш-60, який функціонує у вигляді олігомерного комплексу, що складається з 14 субодиниць (рис. 5.23).
Ш-60 утворюють два кільця, кожне з яких складається із семи субодиниць, сполучених одна з одною. Субодиниця Ш-60 складається з трьох доменів: апікального (верхівкового), проміжного та екваторіального. Верхівковий (апікальний) домен має ряд гідрофобних залишків, спрямованих у порожнину кільця, сформованого субодиницями. Екваторіальний домен має ділянку зв'язування з АТФ і володіє АТФазною активністю, тобто здатен гідро- лізувати АТФ до АДФ і Н3РО4.
Шапероновий комплекс має високу спорідненість до білків, на поверхні яких є елементи, характерні для не згорнутих молекул (передусім ділянки, збагачені гідрофобними радикалами). Опиняючись у порожнині шаперонового комплексу, білок зв'язується з гідрофобними радикалами апікальних ділянок Ш-60. У специфічному середовищі цієї порожнини, в ізоляції від інших молекул клітини відбувається перебирання можливих конформацій білка, поки не буде знайдена єдина, найбільш енергетично вигідна конформація. Вивільнення білка зі сформованою нативною конформацією супроводжується гідролізом АТФ у екваторіальному доме
ні. Якщо білок не набув нативної конформації, він повторно зв'язується із шапероновим комплексом. Такий шаперонозалежний фолдинг білків потребує витрат великої кількості енергії.
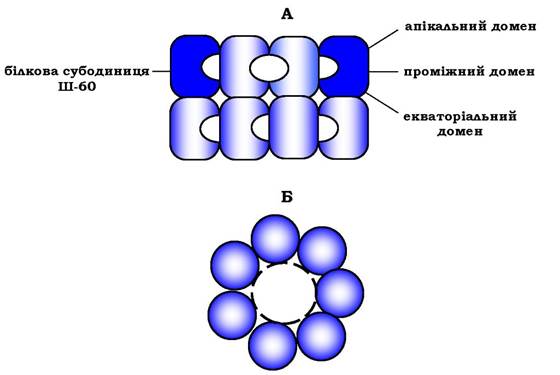
Рис. 5.23. Структура шаперонового комплексу, що складається з 14 білкових молекул Ш-60:
А - вигляд збоку; Б - вигляд зверху
Отже, синтез і фолдинг білків відбуваються за участю різних груп шаперонів, які запобігають небажаній взаємодії білків з іншими молекулами клітини й супроводжують їх до остаточного формування нативної структури (рис. 5.24).
Шаперони, котрі беруть участь у захисті клітинних білків від денатуруючих впливів, як уже йшлося вище, належать до білків теплового шоку (БТШ) і в літературі часто позначаються як HSP (від англ. heat shock protein).
Під час дії різних стресових факторів (висока температура, гіпоксія, інфекція, УФ-випромінювання, зміна рН середовища, зміна молярності середовища, дія токсичних хімічних речовин, важких металів тощо) у клітинах посилюється синтез БТШ. Маючи високу спорідненість до гідрофобних ділянок частково денатурованих білків, вони можуть попереджати їхню повну денатурацію й відновлювати нативну конформацію білків.
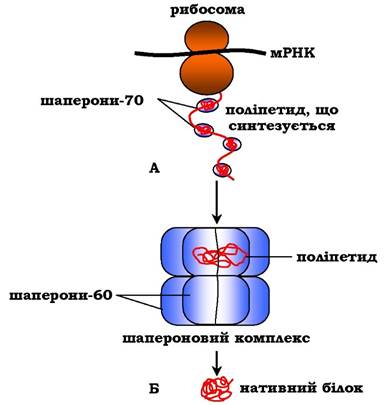
Рис. 5.24. Участь шаперонів у фолдингу білків:
А - участь шаперонів-70 у відвертанні гідрофобних взаємодій між ділянками поліпептиду, що синтезується;
Б - формування нативної конформації білка в шапероновому комплексі
Установлено, що короткочасні стресові впливи збільшують вироблення БТШ і підвищують стійкість організму до довгострокових стресових впливів. Так, короткочасна ішемія серцевого м'яза в період бігу під час помірних тренувань значно підвищує стійкість міокарда до довготривалої ішемії, викликаної стенокардією або закупорюванням судин серця тромбом. У наш час перспективними дослідженнями в медицині вважають пошуки фармакологічних і молекулярно-біологічних засобів активації синтезу БТШ у клітинах.