БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.7. Фізико-хімічні властивості білків і методи їх виділення
5.7.2. Методи виділення й очищення білків
Отримання індивідуальних білків із біологічного матеріалу (тканин, органів, клітинних структур) потребує проведення послідовних операцій, що включають:
✵ подрібнення біологічного матеріалу й руйнування клітинних мембран;
✵ фракціонування органел, що містять ті чи інші білки;
✵ екстракція білків (переведення їх у розчинний стан);
✵ розділення суміші білків на індивідуальні білки.
Методи руйнування тканин і екстракції білків. Для руйнування біологічного матеріалу використовують такі методи, як гомогенізації тканини; почергового заморожування і танення; обробку клітин ультразвуком.
Гомогенізація біологічного матеріалу. Тканину в буферному розчині з певним значенням рН і концентрацією солей, уміщують у гомогенізатор. Під час обертання вона подрібнюється й розтирається за рахунок проштовхування її між її притертими стінками й товкачкою.
У результаті почергового замороження й танення утворені кристали льоду руйнують оболонки клітин.
Після руйнування тканини нерозчинні частинки осаджують центрифугуванням. Наступні центрифугування гомогенату з різними швидкостями дозволяють отримати окремі фракції, що мають своєму складі клітинні ядра, мітохондрії та інші органели, а також надосадову рідину, в якій є розчинні білки цитозолю клітини. Білок міститиметься в одній із цих фракцій.
Екстракція білків, зв’язаних із мембранами, і руйнування олігомерних білків до протомерів. Білок, який міцно зв'язаний із певними структурами клітини, необхідно перевести в розчин. Для руйнування гідрофобних взаємодій між білками й ліпідами мембран до розчину додають детергенти; найчастіше використовують тритон Х-100 або додецилсульфат натрію. Механізм дії детергентів описано в розділі "Денатурація білків». Унаслідок дії детергентів зазвичай руйнуються і гідрофобні взаємодії між протомерами в олігомерних білках.
Видалення з розчину небілкових речовин. Нуклеїнові кислоти, ліпіди та інші небілкові речовини можна видалити з розчину, використовуючи їхні особливі фізико-хімічні властивості. Так, ліпіди легко видаляються з розчину додаванням органічних розчинників, наприклад ацетону. Але такий вплив має бути короткочасним, оскільки ацетон викликає денатурацію деяких білків. Нуклеїнові кислоти осаджують додаванням до розчину стрептоміцину.
Методи очищення білків. Найбільш трудомістким етапом отримання індивідуальних білків є очищення їх від інших білків, що містяться в розчині, отриманому з даної тканини. Часто білок, який вивчається, присутній у невеликих кількостях і становить частки відсотка від усіх білків розчину.
Оскільки білкам притаманна конформаційна лабільність, під час роботи з ними потрібно уникати денатуруючих впливів, тому виділення й очищення білків проводять за низьких температур.
На перших стадіях очищення білків доцільно використовувати методи, що враховують деяку характерну особливість даного білка, скажімо, термостабільність або стійкість у кислих розчинах. Першими методами очищення необхідно видалити з розчину основну масу баластних білків, які значно відрізняються від досліджуваного білка своїми фізико-хімічними властивостями. Після цього використовують більш тонкі методи очищення білка.
Очищення білків вибірковою денатурацією. Більшість білків денатурує й випадає в осад уже при короткочасному нагріванні розчину до 50-70 °С або підкисленні розчину до рН 5. Якщо білок, який виділяється, витримує ці умови, то за допомогою вибіркової денатурації можна видалити більшість сторонніх білків, відфільтрувавши білки, що випали в осад, або осадити їх центрифугуванням.
Висолювання - метод очищенням білків, заснований на відмінностях у їхній розчинності за різних концентрацій солі в розчині. Солі лужних і лужноземельних металів викликають оборотне осадження білків, тобто після видалення їх білки знову набувають здатності розчинятися, зберігаючи при цьому свої нативні властивості.
Найчастіше для розділення білків методом висолювання використовують різні концентрації солей сульфату амонію - (NH4)2SO4. Чим вища розчинність білка, тим більша концентрація солі потрібна для його висолювання.
Для розділення білків часто використовують хроматографічні методи, засновані на розподіленні речовин між двома фазами, одна з яких рухлива, а інша нерухлива. В основу хроматографічних методів покладені різні принципи: гель-фільтрації, іонного обміну, адсорбції, біологічної спорідненості.
Метод розділення білків за допомогою гель-фільтраційної хроматографії (або молекулярного сита) заснований на тому, що речовини, які відрізняються молекулярною масою, по-різному розподіляються між рухливою та нерухливою фазами. Хроматографічна колонка заповнюється гранулами пористої речовини (сефадекс, агароза та ін.). У структурі полісахариду утворюються поперечні зв'язки й формуються гранули з "порами", через які легко проходить вода і низькомолекулярні сполуки. Залежно від умов можна формувати гранули з різною величиною "пор".
Нерухома фаза - рідина всередині гранул, в яку здатні проникати низькомолекулярні речовини й білки з невеликою молекулярною масою. Суміш білків, нанесену на хроматографічну колонку, вимивають (елюють), пропускаючи через колонку розчинник. Разом із фронтом розчинника рухаються й найбільші молекули.
Менші молекули дифундують усередину гранул сефадексу та на деякий час потрапляють до нерухомої фази, у результаті чого їхній рух затримується. Величина пор визначає розмір молекул, здатних проникати всередину гранул (рис. 5.54).
Оскільки гелева структура сефадексу легко деформується під тиском, гелі почали заміняти жорсткішими матрицями (сефактил, тойоперл), що являють собою сферичні гранули з різними розмірами пор. Вибір розмірів пор у гранулах залежить від мети хроматографії (інші хроматографічні методи будуть описані нижче).
Ультрацентрифугування. Цей метод розділення також базується на відмінностях у молекулярних масах білків. Швидкість седиментації речовин у процесі обертання в ультрацентрифузі, де відцентрове прискорення досягає 100 000-500 000 g, є пропорційною до їхньої молекулярної маси. На поверхню буферного розчину, поміщеного в кювету, наносять тонкий шар суміші білків. Кювету розміщують у роторі ультрацентрифуги. Унаслідок обертання ротора протягом 10-12 год більші молекули (з більшою молекулярною масою) осідають у буферному розчині з більшою швидкістю. У результаті в кюветі відбувається розшарування суміші білків на окремі фракції з різною молекулярною масою (рис. 5.55). Після розшарування білкових фракцій дно кювети проколюють голкою й по краплинах збирають вміст невеликими порціями у пробірки.
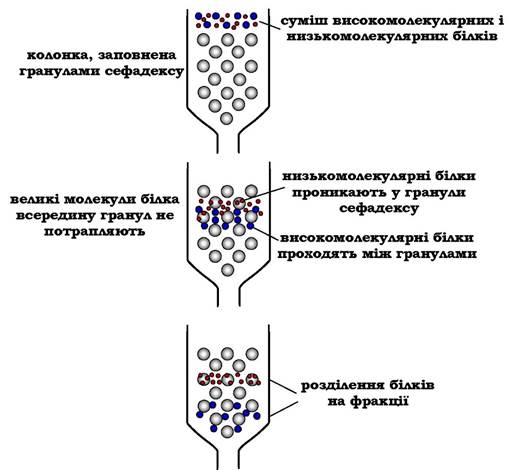
Рис. 5.54. Розділення суміші білків методом гель-фільтрації
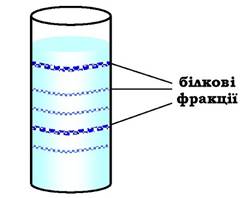
Рис. 5.55. Кювета, заповнена буферним розчином з розділеними білковими фракціями
Електрофорез білків. Метод заснований на тому, що за певного значення рН та іонної сили розчину білки рухаються в електричному полі зі швидкістю, пропорційною їхньому сумарного заряду. Білки із сумарним негативним зарядом рухаються до аноду (+), а позитивно заряджені білки - до катоду (-).
Електрофорез проводять на різних носіях: папері, крохмальному гелі, поліакриламідному гелі та ін. На відміну від електрофорезу на папері, де швидкість руху білків пропорційна тільки їхньому сумарному заряду, у поліакриламідному гелі швидкість руху білків є пропорційною їхнім молекулярним масам.
Роздільна здатність електрофорезу в поліакриламідному гелі вища, ніж на папері. Так, при електрофорезі білків сироватки крові людини на папері виявляють лише п'ять головних фракцій: альбуміни, αι-глобуліни, α2-глобуліни, β-глобуліни і γ-глобуліни (рис. 5.56). Електрофорез тих самих білків у поліакриламідному гелі дозволяє отримати до 18 окремих фракцій. Для виявлення білкових фракцій смужки паперу або стовпчики гелю обробляють барвником (найчастіше бромфеноловим синім або амідовим чорним). Забарвлений комплекс білків із барвником дозволяє виявити розміщення різних фракцій на носії.
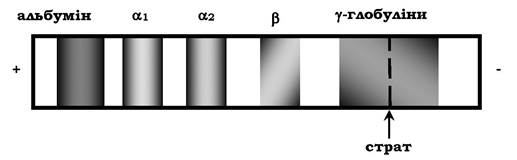
Рис. 5.56. Електрофорез білка сироватки крові здорової людини (на папері)
Іонообмінна хроматографія так само, як і електрофорез, заснований на розділенні білків, які відрізняються сумарним зарядом за певних значень рН та іонної сили розчину. Під час пропускання розчину білків через хроматографічну колонку, заповнену твердим пористим зарядженим матеріалом, частина білків затримується на ньому в результаті електростатичних взаємодій. Як нерухому фазу використовують іонообмінники - полімерні органічні речовини, що містять заряджені функціональні групи.
Розрізняють позитивно заряджені аніонообмінники, серед яких найчастіше використовують діетиламіноетилцелюлозу (ДЕАЕ-целюлозу), що містить катіонні групи, і негативно заряджені катіонообмінники, наприклад карбоксиметилцелюлозу (КМ-целюлозу), яка містить аніонні групи:
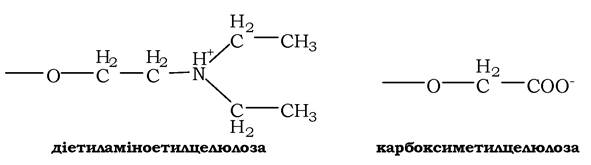
Вибір іонообмінника визначається зарядом досліджуваного білка. Так, для виділення негативно зарядженого білка використовують аніонообмінник. Під час пропускання розчину білка через колонку міцність зв'язування білка з аніонообмінником залежить від кількості негативно заряджених карбоксильних груп у молекулі. Білки, адсорбовані на аніонообміннику, можна змити (елюювати) буферними розчинами з різною концентрацією солі, найчастіше NaCl, і різними значеннями рН. Іони хлору зв'язуються з позитивно зарядженими функціональними групами аніонообмінника й витісняють карбоксильні групи білків. За низьких концентрацій солі будуть елююватися білки, слабко зв'язані з аніонообмінником. Поступове збільшення концентрації солі або зміна рН, яка змінює заряд білкової молекули, приводить до виділення білкових фракцій, в одній із яких міститься шуканий білок.
Найспецифічнішим методом виділення індивідуальних білків є афінна хроматографія (або хроматографія за спорідненістю), заснований на вибірковій взаємодії білків із лігандами, закріпленими (іммобілізованими) на твердому носії. Як ліганд може бути використаний субстрат або кофермент, якщо виділяють певний фермент, антигени - для виділення антитіл і т. д. Через колонку, заповнену іммобілізованим лігандом, пропускають розчин із сумішшю білків. До ліганду приєднується тільки той білок, який специфічно з ним взаємодіє; усі інші білки виходять з елю- атом (рис. 5.57). Білок, адсорбований на колонці, можна зняти, промивши її розчином зі зміненим значенням рН або зміненою іонною силою. У деяких випадках використовують розчин детергенту, який розриває гідрофобні зв'язки між білком і лігандом.
Афінна хроматографія відрізняється високою вибірковістю та дозволяє очистити виділений білок у тисячі разів.
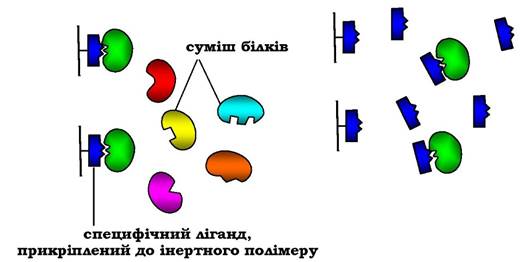
Рис. 5.57. Афінна хроматографія
Для видалення низькомолекулярних сполук, зокрема сульфату амонію після висолювання, використовують діаліз. Метод заснований на тому, що через напівпроникну мембрану, яка пропускає низькомолекулярні сполуки, не проходять білки з більшою молекулярною масою. У склянку великої ємності (близько 1 л) з буферним розчином занурюють напівпроникний мішечок, заповнений розчином білка з сіллю.
Швидкість виходу солі з мішечка в буферний розчин пропорційна градієнту його концентрацій по обидва боки мембрани. По мірі виходу солі з мішечка буферний розчин у склянці міняють.
Для очищення білків від низькомолекулярних домішок використовують також метод гель-фільтрації.
Для визначення чистоти (гомогенності) виділеного білка використовують методи з високою роздільною здатністю: електрофорез у поліакриламідному гелі, високоефективну хроматографію високого тиску. Від чистоти лікарського білкового препарату залежать його біологічна ефективність та алергенність (тобто здатність викликати алергічні реакції). Чим якісніше очищений препарат, тим менш вірогідною є поява ускладнень під час його застосування.