БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.5. Обмін аміаку. Орнітиновий цикл
6.5.2.Орнітиновий цикл
Сечовина - основний кінцевий продукт азотистого обміну, у складі якого з організму виділяється до 90 % усього азоту, що виводиться (рис. 6.15). Екскреція сечовини в нормі становить ~ 25 г/доб.
При підвищенні кількості спожитих з їжею білків екскреція сечовини збільшується. Сечовина синтезується лише в печінці, що було встановлено ще в дослідах І. П. Павлова. Ураження печінки й пору-
шення синтезу сечовини викликає підвищення вмісту в крові та тканинах аміаку та амінокислот (насамперед глутаміну й аланіну).
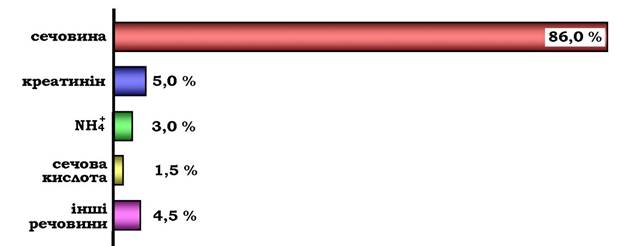
Рис. 6.15. Кількість азотовмісних речовин у сечі (%) за нормального білкового харчування
У 40-х рр. ХХ ст. німецькі біохіміки Г. Кребс і К. Гензелейт установили, що синтез сечовини являє собою циклічний процес, який складається з декількох стадій, ключовою сполукою якого є орнітин, котрим починається і завершується цикл. Тому процес синтезу сечовини отримав назву орнітиновий цикл, або цикл Кребса - Гензелейта.
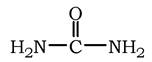
Сечовина (карбамід) - повний амід вугільної кислоти - містить два атоми азоту:
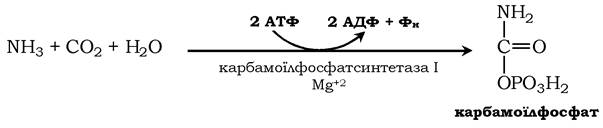
Джерелом одного з них є аміак, який у печінці зв'язується з діоксидом вуглецю з утворенням карбамоїлфосфату під дією карбамоїлфосфатсинтетази І:
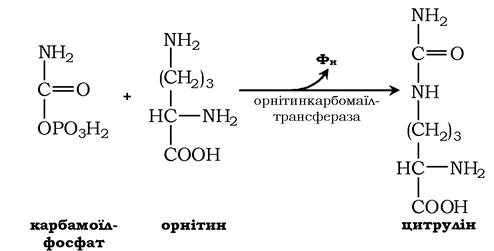
Далі під дією орнітинкарбамоїлтрансферази карбамоїльна група карбамоїлфосфату переноситься на α-амінокислоту орнітин і утворюється інша α-амінокислота - цитрулін:
У наступній реакції аргінінсукцинатсинтетаза зв'язує цитрулін з аспартатом і утворює аргінінсукцинат (аргінінобурштинову кислоту). Цей фермент потребує іони Mg2+. У реакції витрачається 1 моль АТФ, але використовується енергія двох макроергічних зв'язків. Аспартат - джерело другого атома азоту сечовини:
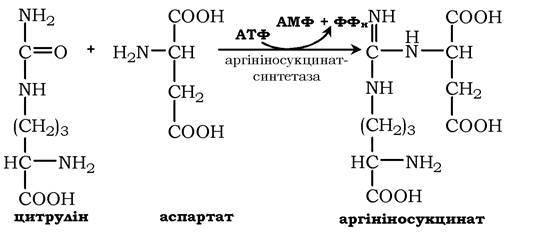
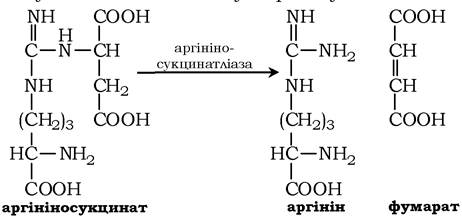
Далі фермент аргінінсукцинатліаза (аргінінсукциназа) розщеплює аргінінсукцинат на аргінін і фумарат, при цьому аміногрупа аспартату опиняється в молекулі аргініну:
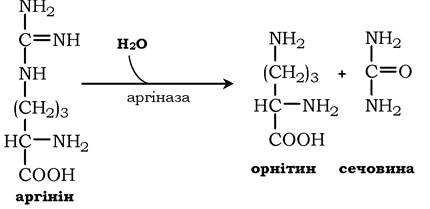
Аргінін піддається гідролізу під дією аргінази, при цьому утворюється орнітин і сечовина. Кофакторами аргінази є іони Са2+ або Mn2+. Високі концентрації орнітину й лізину, що є структурними аналогами аргініну, пригнічують активність цього ферменту:
Утворений орнітин взаємодіє з новою молекулою карбамоїлфосфату й цикл замикається.
Перші дві реакції процесу відбуваються в мітохондріях гепатоцитів. Потім цитрулін, що є продуктом цих реакцій, транспортується в цитозоль, де і здійснюється подальше перетворення (рис. 6.16).
Сумарне рівняння синтезу сечовини:
![]()
Аміак, який використовується карбамоїлфосфатсинтетазою І, постачається в печінку з кров'ю ворітної вени. Роль інших джерел, зокрема й окисного дезамінування глутамінової кислоти в печінці, суттєво менша.
Аспартат, необхідний для синтезу аргінінсукцинату, утворюється в печінці шляхом трансамінування аланіну з оксалоацетатом. Аланін надходить головним чином із м'язів і клітин кишечнику. Джерелом оксалоацетату, необхідного для цієї реакції, можна вважати перетворення фумарату, утвореного в реакціях орнітинового циклу. Фумарат у результаті двох реакцій цитратного циклу перетворюється в оксалоацетат, з якого шляхом трансамінування утворюється аспартат (рис. 6.17). Таким чином, з орнітиновим циклом поєднаний цикл регенерації аспартату з фумарату. Піруват, що утворюється в цьому циклі з аланіну, використовується для глюконеогенезу.
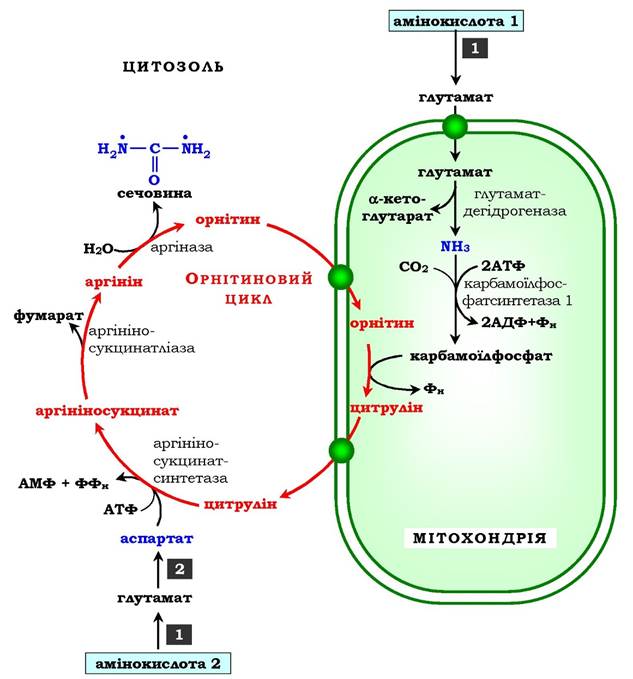
Рис. 6.16. Орнітиновий цикл Кребса - Гензелейта:
1 - трансамінування з а-кетоглутаратом; 2 - трансамінування з оксало- ацетатом. Окисне дезамінування глутамату відбувається в мітохондріях. Ферменти орнітинового циклу розподілені між мітохондріями та цитозолем. Тому необхідним є трансмембранне перенесення глутамату, цитруліну й орнітину за допомогою специфічних транслоказ.
На схемі показано шляхи включення азоту двох різних амінокислот (амінокислота 1 і амінокислота 2) у молекулу сечовини:
• одна аміногрупа - у вигляді аміаку в матриксі мітохондрії, а другу аміногрупу постачає аспартат цитозолю
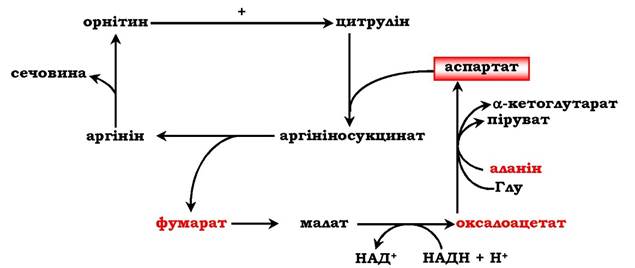
Рис. 6.17. Цикл регенерації аспартату, поєднаного з орнітиновим циклом
Ще одним джерелом аспартату для орнітинового циклу є трансамінування глутамату з оксалоацетатом.
У реакціях орнітинового циклу витрачається чотири макроергічні зв'язки трьох молекул АТФ на кожен оберт циклу. Проте процес перетворення амінокислот у безазотисті залишки й сечовину має шляхи компенсації енерговитрат:
✵ при включенні фумарату в ЦТК на стадії дегідрування малату утворюється НАДН, яка забезпечує синтез трьох молекул АТФ (рис. 6.18);
✵ при окисному дезамінуванні глутамату в різних органах також утворюється НАДН, відповідно - ще три молекули АТФ.
Витрати енергії відбуваються також і при трансмембранному перенесенні речовин, пов'язаних із синтезом та екскрецією сечовини (рис. 6.18). Перші дві реакції орнітинового циклу проходять у мітохондріях, а наступні три - у цитозолі. Цитрулін, який утворюється в мітохондрії, має бути перенесений у цитозоль, а орнітин, що утворюється в цитозолі, необхідно транспортувати в мітохондрію. Крім того, у нирках перенесення сечовини з крові в сечу відбувається шляхом активного транспорту за рахунок градієнта іонів натрію, утворюваного К+, На+-АТФазою, що також пов'язано з енерговитратами.
Повний набір ферментів орнітинового циклу є тільки в гепа- тоцитах. Окремі ж ферменти цього циклу знаходять не лише в печінці, але й в інших клітинах. В ентероцитах, наприклад, є ка- рбамоїлфосфатсинтетаза І та орнітинкарбамоїлтрансфераза, отже, може синтезуватися цитрулін. У нирках знайдені аргінінсук- цинатсинтетаза та аргінінсукцинатліаза. Цитрулін, що утворився в ентероцитах, може надходити в нирки й перетворюватись там у аргінін, який переноситься в печінку та гідролізується аргіназою. Активність цих розсіяних по різних органах ферментів значно нижча, ніж у печінці.
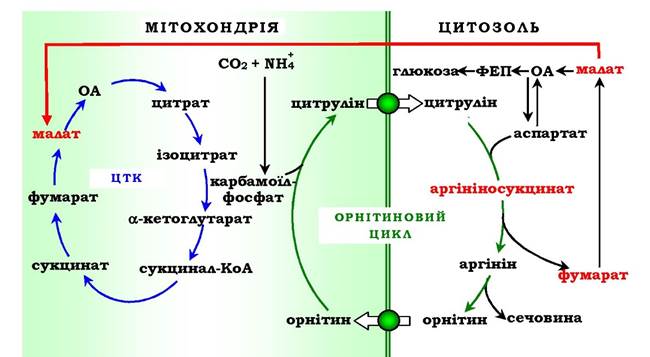
Рис. 6.18. Взаємозв'язок орнітинового циклу й загального шляху катаболізму.
Фумарат, що утворюється в результаті розщеплення аргінінсукцинату, перетворюється в малат, який потім переноситься в мітохондрії, включається в ЦТК і дегідрує з утворенням оксалоацетату. Ця реакція супроводжується виділенням трьох молекул АТФ, які й компенсують витрати енергії на синтез однієї молекули сечовини
Орнітиновий цикл у печінці виконує дві функції:
✵ перетворення азоту амінокислот у сечовину, яка екскретується й запобігає накопиченню токсичних продуктів, головним чином аміаку;
✵ синтез аргініну та поповнення його фонду в організмі. Регуляторні стадії процесу - синтез карбамоїлфосфату, синтез цитруліну й завершальна стадія, що каталізується аргіназою. Ефективність роботи орнітинового циклу при нормальному харчуванні людини та помірних фізичних навантаженнях становить приблизно 60 % його потужності. Запас потужності необхідний для запобігання гіперамоніємії при змінах кількості білка в їжі. Збільшення швидкості синтезу сечовини спостерігається при тривалій фізичній праці або тривалому голодуванні, яке супроводжується розпадом тканинних білків. Деякі патологічні
стани, що характеризуються інтенсивним розпадом білків тканин (цукровий діабет та ін.), також супроводжуються активацією орнітинового циклу. При надлишковому білковому харчуванні кількість ферментів орнітинового циклу в печінці збільшується, що приводить до інтенсифікації синтезу сечовини.
Порушення реакцій знешкодження аміаку може викликати підвищення вмісту аміаку в крові - гіперамоніємію, що токсично діє на організм. Причинами гіперамоніємії можуть бути як генетичний дефект ферментів орнітинового циклу в печінці, так і вторинне ураження печінки в результаті цирозу, гепатиту та інших захворювань. Відомо п'ять спадкових захворювань, зумовлених дефектом п'яти ферментів орнітинового циклу (табл. 6.4). У літературі описано випадки всіх цих досить рідких ензимопатій, серед яких відмічено найбільше випадків гіперамоніємії ІІ типу.
Таблиця 6.4
Спадкові порушення орнітинового циклу та основні їхні прояви
Захво- |
Дефект |
Тип |
Клінічні |
Метаболіти |
|
рювання |
ферменту |
спадковості |
прояви |
кров |
сеча |
Гіперамоніємія, тип І |
Карбамоїлфосфатсин- тетаза І |
Аутосомно- рецесивний |
Протягом 24-48 год після народження кома, смерть |
Глі Ала NH3 |
Оротат |
Гіперамоніємія, тип ІІ |
Орнітин карбамоїл трансфераза |
Зчеплення з Х-хромосомою |
Гіпотонія, зниження толерантності до білків |
Глі Ала NH3 |
Оротат |
Цитрулінемія |
Аргінін сукцинатсинтетаза |
Аутосомнорецесивний |
Гіперамоніємія тяжка в новонароджених. У дорослих - після білкового навантаження |
Цитрулін |
Цитрулін |
NH3 |
|||||
Аргінінсукцина- турія |
Аргінінсукцинатліаза |
Аутосомнорецесивний |
Гіперамоніємія, атаксія, судоми,випадання волосся |
Аргінін- |
Аргінінсукцинат Глн, Ала, Ліз |
сукцинат |
|||||
NH3 |
|||||
Гіпераргінінемія |
Аргіназа |
Аутосомнорецесивний |
Гіпераргінінемія |
Арг |
Арг Ліз Орнітин |
NH3 |
|||||
Порушення орнітинового циклу спостерігається при гепатитах різної етіології та деяких інших вірусних захворюваннях. Наприклад, установлено, що віруси грипу та інших гострих респіраторних вірусних інфекцій знижують активність карбамоїлфосфатсинтетази І. При цирозі та інших захворюваннях печінки також часто спостерігають гіперамоніємію.
Зниження активності якого-небудь ферменту синтезу сечовини приводить до накопичення в крові субстрату даного ферменту та його попередників. Так, у разі дефекту аргінінсукцинатсинтетази підвищується вміст цитруліну (цитрулінемія); при дефекті аргінази - концентрація аргініну, аргінінсукцинату, цитруліну і т. д. При гіперамонієміях І та ІІ типу внаслідок дефекту орнітинкарбамоїлтрансферази відбувається накопичення карбамоїлфосфату в мітохондріях і вихід його в цитозоль. Це викликає збільшення швидкості синтезу піримідинових нуклеотидів (унаслідок активації карбамоїлфосфатсинтетази ІІ), що приводить до накопичення оротату, уридину та урацилу й виведення їх із сечею. Вміст усіх метаболітів підвищується, і стан хворого погіршується при збільшенні кількості білків у їжі. Тяжкість перебігу захворювання залежить також від ступеня зниження активності ферментів. Усі порушення орнітинового циклу викликають значне підвищення в крові концентрації аміаку, глутаміну й аланіну.
Гіперамоніємія супроводжується проявом наступних симптомів:
✵ нудота, періодичне блювання;
✵ запаморочення голови, судоми;
✵ втрата свідомості, набряк мозку (у тяжких випадках);
✵ відставання розумового розвитку (при хронічній уродженій формі).
Усі симптоми гіперамоніємії - прояв дії аміаку на ЦНС. Для діагностики різних типів гіперамоніємії проводять визначення вмісту аміаку в крові, метаболітів орнітинового циклу в крові та сечі, активності ферменту в біоптатах печінки.
Основна діагностична ознака - підвищення аміаку в крові. Вміст аміаку в крові може досягати 6000 мкмоль/л (у нормі - 60 мкмоль/л). Проте в більшості хронічних випадків рівень аміаку може підвищуватись лише після білкового навантаження або протягом гострих ускладнень захворювання.
Лікування хворих з різними дефектами орнітинового циклу направлене в основному на зниження концентрації аміаку в крові за рахунок малобілкової дієти, уведення кетоаналогів амінокислот у раціон і стимуляцію виведення аміаку в обхід порушених реакцій:
✵ шляхом зв'язування й виведення у складі фенілацетилглутаміну та гіпурової кислоти;
✵ підвищенням концентрації проміжних метаболітів циклу (аргініну, цитруліну, глутамату), які утворюються поза блокованими реакціями (рис. 6.19).
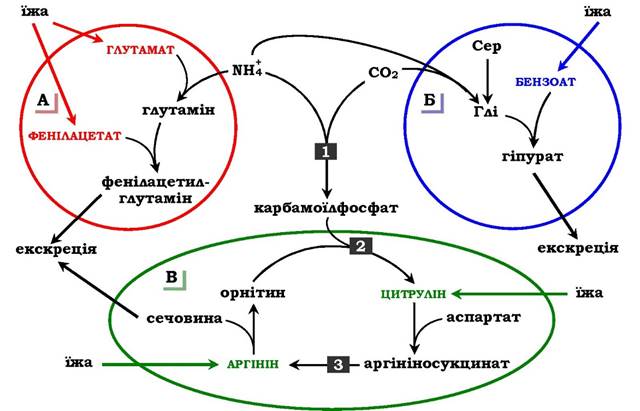
Рис. 6.19. Шляхи виведення аміаку при додаванні в дієту глутамату й фенілацетату (А), бензоату (Б), цитруліну та аргініну (В). Ферментні блоки: 1 - дефект карбамоїлфосфатсинтетази І; 2 - дефект орнітинкарбамоїлтрансферази; 3 - дефект аргінінсукцинатліази
Фенілацетат, який уводиться хворому з дефектом карбамоїлфосфатсинтетази І як харчова добавка, у результаті його кон'югації з глутаміном утворює фенілацетилглутамін, що екскретується нирками. Стан хворого при цьому поліпшується, оскільки відбувається активація синтезу глутаміну та зниження концентрації аміаку в крові (рис. 6.19, А).
Аналогічна дія спостерігається при введенні бензоату, який зв'язує молекулу гліцину. Утворена гіпурова кислота виводиться із сечею (рис. 6.19, Б). У складі гіпурату відбувається виділення азоту з організму. Нестача гліцину компенсується або шляхом синтезу його із серину, або за рахунок утворення із та СО2 у реакції, що каталізується гліцинсинтетазою. При цьому утворення гліцину супроводжується зв'язуванням однієї молекули аміаку.
При гіперамоніємії ІІ типу (дефект орнітинкарбамоїлтрансферази) уведення великих доз цитруліну стимулює синтез сечовини з аспартату (рис. 6.19, В), що також зумовлює виведення азоту з організму. Уведення великих доз аргініну при аргінінсукцинатурії (дефект аргінінсукцинатліази) стимулює регенерацію орніти- ну й виведення азоту в складі цитруліну та аргінінсукцинату.
Обмін аміаку й амінокислот між органами та тканинами. У катаболізмі амінокислот і утворенні аміаку беруть участь багато тканин. У клітинах відбувається зв'язування аміаку. З організму азот виводиться нирками у вигляді двох кінцевих продуктів азотистого обміну - амонійних солей (~ 0,5 г/доб), котрі утворюються в нирках, і сечовини (~ 25 г/доб), яка містить до 90 % азоту, що виводиться. Синтез сечовини відбувається в печінці в орнітиновому циклі, причому на утворення 1 молю сечовини використовується 1 моль аміаку та 1 моль аспарагінової кислоти. Отже, для синтезу 25 г сечовини за добу витрачається 6,3 г аміаку та 50 г аспартату. Для доставки азоту в печінку повинні інтенсивно функціонувати спеціальні механізми.
Транспортування азоту з тканин у печінку відбувається головним чином у складі трьох сполук: глутаміну, аланіну, аміаку (невелика кількість у незв'язаному вигляді).
Крім глутаміну та аланіну, у крові присутні й інші вільні амінокислоти, причому їхній вміст і напрямок транспортування залежить від прийому їжі та використання ендогенних білків. Найбільша кількість вільних амінокислот надходить із м'язів і кишечнику, причому до 50 % - аланін і глутамін. Існує направлений потік амінокислот із цих тканин у печінку, який посилюється в абсорбтивний період при білковому харчуванні.
Основну кількість глутаміну постачають у кров м'язи та мозок. Із кров'яного русла його поглинають печінка й нирки, де він піддається дії глутамінази. Нирки - основне джерело серину і частково аланіну, які сорбуються із плазми печінкою. Головний мозок, на відміну від усіх інших тканин, здатний поглинати й окиснювати великі кількості амінокислот з розгалуженим боковим ланцюгом (валін, лейцин, ізолейцин).
Після прийняття їжі з кишечнику в плазму крові надходить багато амінокислот, причому переважають амінокислоти з розгалуженим боковим ланцюгом (до 20 % від загальної кількості), які потім поглинаються в основному печінкою, м'язами та мозком (рис. 6.20). У м'язах відбувається посилений катаболізм цих амінокислот, причому вони виступають основними донорами аміногрупи в синтезі аланіну з пірувату (див. Тлюкозоаланіновий цикл»).
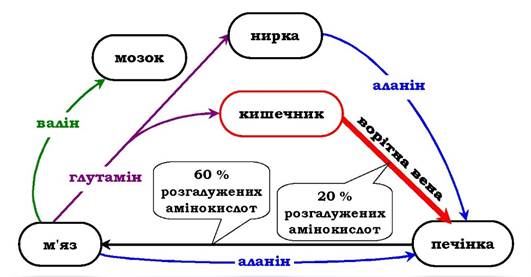
Рис. 6.20. Обмін амінокислот між тканинами й органами в абсорбтивному періоді
У постабсорбтивному періоді основним джерелом вільних амінокислот є м'язи. Вони постачають головним чином аланін і глутамін (рис. 6.21). Аланін поглинається печінкою, глутамін - кишечником і нирками. У кишечнику азот глутаміну переноситься в аланін або серин і в їхньому складі транспортується в печінку, де активується процес глюконеогенезу. Інтенсивність глюкогенезу з цих амінокислот набагато вищий, ніж з усіх інших. Отже, аланін і серин - основні глікогенні амінокислоти. Амінокислоти з розгалуженим боковим ланцюгом (валін, лейцин, ізолейцин тощо), які вивільнюються з м'язів, направляються в мозок, де оки- снюються і служать важливим джерелом енергії.
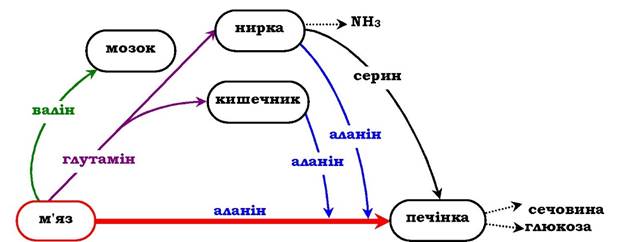
Рис. 6.21. Обмін амінокислот між тканинами та органами в постабсорбтивний період