БИОЛОГИЯ Том 1 - руководство по общей биологии - 2004
4. ФЕРМЕНТЫ
Ферменты можно определить, как биологические катализаторы. Катализатором называют вещество, ускоряющее реакцию, но само в реакции не изменяющееся. Поскольку ферменты представляют собой белковые молекулы, синтезируемые в живой клетке, их называют биологическими катализаторами. В любой клетке человеческого тела содержатся тысячи ферментов. Они катализируют многочисленные химические реакции, протекающие здесь при температурах, совместимых с жизнью, т. е. в пределах от 5 до 40 °С. Чтобы эти реакции с той же скоростью осуществлялись вне организма, потребовались бы высокие температуры и резкие изменения некоторых других условий, что было бы для клетки губительным. Ферменты абсолютно необходимы, поскольку без них реакции в клетке протекали бы слишком медленно и не могли бы поддерживать жизнь.
Вещество, превращения которого катализирует данный фермент, называют субстратом этого фермента. Соединяясь с субстратом, фермент образует короткоживущий фермент-субстратный комплекс. В таком комплексе шансы на то, что реакция произойдет, значительно возрастают. По завершении реакции фермент-субстратный комплекс распадается на продукт (или продукты) и фермент. Фермент в реакции не изменяется и по ее окончании может снова взаимодействовать с новой молекулой субстрата:

или
![]()
Анаболизм и катаболизм
Совокупность всех химических реакций, протекающих в клетке, составляет то, что мы называем метаболизмом. Метаболизм подразделяется на анаболизм и катаболизм — два разных типа реакций, которые нередко протекают и в разных частях клетки. Катаболические реакции, или реакции распада, обычно сопровождаются высвобождение энергии. По большей части это окисление и гидролиз. Анаболические реакции, или реакции синтеза, наоборот, требуют затрат энергии. Часто это реакции конденсации. Все эти реакции протекают с участием ферментов. Примером фермента, участвующего в анаболизме, может служить глутаминсинтетаза, катализирующая синтез аминокислоты глутамина из глутаминовой кислоты и аммиака:
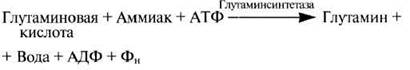
(АТФ — аденозинтрифосфат; АДФ — аденозин- дифосфат; Фн — неорганический фосфат). В качестве примера фермента, участвующего в катаболизме, можно назвать мальтазу:
![]()
Метаболические пути
Обычно данное исходное вещество превращается в продукт (или продукты) через ряд промежуточных соединений, в образовании которых принимают участие несколько ферментов, действующих последовательно один за другим. Такая последовательность реакций составляет так называемый метаболический путь. В клетке работает одновременно много метаболических путей. Реакции протекают согласованно, подчиняясь строгой регуляции, что объясняется специфической природой ферментов. Один фермент обычно катализирует только одну реакцию. Таким образом, ферменты служат для регулирования происходящих в клетке реакций и обеспечивают надлежащую их скорость.
4.1. Свойства ферментов
Ферменты характеризуются следующими основными свойствами.
1. Все они представляют собой глобулярные белки.
2. Информация о них, как и о других белках, закодирована в ДНК.
3. Ферменты действуют как катализаторы (см. выше).
4. Их присутствие не влияет ни на природу, ни на свойства конечного продукта (или продуктов) реакции.
5. Ферменты действуют чрезвычайно эффективно, т. е. очень малое количество фермента вызывает превращение больших количеств субстрата. Одна молекула каталазы способна, например, при температуре тела разложить за одну секунду на воду и кислород около 600 тысяч молекул пероксида водорода. Можно сравнить эффективность каталазы и такого, например, неорганического катализатора, как диоксид марганца, добавив их по отдельности к пероксиду водорода и измерив скорость выделения кислорода. (Хорошим источником каталазы служит печень). В среднем ферменты способны катализировать около 1000 реакций в секунду. Без катализаторов реакции протекали бы в миллионы раз медленнее.
6. Ферменты высокоспецифичны, т. е. один фермент катализирует обычно только одну реакцию. Каталаза, например, катализирует только расщепление пероксида водорода.
7. Катализируемая ферментом реакция обратима.
8. Активность ферментов меняется в зависимости от pH и температуры, а также от концентрации как субстрата, так и самого фермента (об этих факторах мы будем говорить в разд. 4.3).
9. Ферменты снижают энергию активации катализируемой реакции (разд. 4.1.1).
10. В молекуле фермента есть активный центр, который вступает в контакт с субстратом. Этот активный центр имеет особую форму (разд. 4.1.2).
4.1.1. Энергия активации
Представим себе смесь бензина и кислорода. Реакция между этими двумя веществами с термодинамической точки зрения возможна, но она не пойдет без затраты некоторого количества энергии, поступившей, например, в форме простой искры. Так же обстоит дело и со спичкой. Содержащиеся в спичечной головке вещества могут вступить в реакцию, суммарным итогом которой будет выделение энергии, но чтобы запустить реакцию, придется сначала затратить небольшое количество энергии (достаточно тепловой энергии, выделяющейся, когда мы чиркаем спичкой о коробок). Энергия, необходимая для того, чтобы заставить вещества вступить в реакцию, называется энергией активации. Ферменты, действуя как катализаторы, снижают энергию активации (рис. 4.1). Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной степени температуру, при которой эта реакция протекает.

Рис. 4.1. А. Энергия активации для катализируемой и некатализируемой реакции. Б. Аналогичная ситуация — когда валун скатывается с холма, высвобождается больше энергии, чем было затрачено на то, чтобы поднять его на холм и заставить скатиться.