Основи біоорганічної хімії (навчальний посібник) - Г. О. Сирова - 2018
Тема
Будова та властивості альдегідів і кетонів
Актуальність теми. Матеріал даної теми є основою для розуміння на молекулярному рівні хімічних процесів, що відбуваються в живих організмах у процесі обміну речовин. Оксопохідні сполуки беруть участь у низці реакцій у біологічних системах. Так, альдольна конденсація подовжує карбоновий ланцюг, дає можливість утворення імінів, має місце в реакціях переамінування, а реакція утворення напівацеталю і ацеталей лежить в основі існування вуглеводів.
Загальні цілі: вивчити загальну характеристику альдегідів і кетонів. Розглянути хімічні властивості оксосполук: реакції нуклеофільного приєднання, окиснення та відновлення.
Конкретні цілі
1. Уміти застосовувати взаємозв’язок електронної й просторової будови функціональних груп оксосполук і їхніх хімічних властивостей.
2. Уміти описати механізм реакції нуклеофільного приєднання (AN) в оксосполуках.
Теоретичні питання
1. Загальна характеристика альдегідів і кетонів.
2. Будова карбонільної групи.
3. Хімічні властивості альдегідів і кетонів:
а) реакції нуклеофільного приєднання (AN);
б) реакції відновлення та окиснення.
4. Якісні реакції на виявлення альдегідної групи.
5. Медико-біологічне та фармацевтичне значення альдегідів і кетонів.
1. Сполуки, що містять карбонільну групу (оксогрупу або карбоніл), називаються оксосполуки. Вони представлені альдегідами й кетонами. Назва альдегідів за міжнародною номенклатурою утворюється шляхом додавання закінчення «аль» до назви відповідного вуглеводню, причому ця група визначає початок нумерації. Наприклад, етаналь.
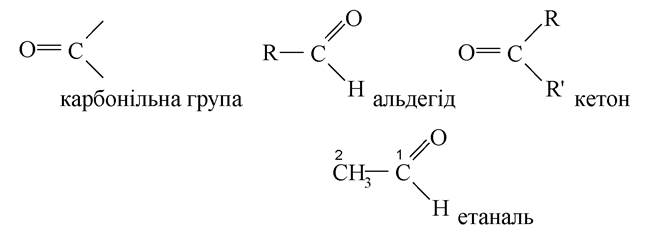
Тривіальні назви альдегідів мають в кореневій основі назву карбонової кислоти з додаванням слова «альдегід» (див. табл.). Наприклад, формальдегід називають мурашиним альдегідом або формальдегідом.
Назва кетонів за міжнародною номенклатурою утворюється шляхом додавання до назви карбонового ланцюга закінчення «-он», положення якого зазначено цифрою, при чому нумерацію починають з найближчого до нього кінця ланцюга молекули. Кетони мають також тривіальні назви, наприклад, дифенілкетон (бензофенон).

Найменування і скорочені структурні формули поширених альдегідів

Найменування й структурні формули поширених кетонів

2. Подвійний зв'язок у карбонільній групі, який утворений карбоном з атомом оксигену - один π-зв'язок і один σ-зв'язок. Унаслідок зсуву електронної густини від атома карбону до атома оксигену в карбонільній групі виникають такі заряди:

Наявність у карбонільних групах альдегідів і кетонів сильно поляризованого подвійного зв'язку є причиною високої реакційної здатності цих сполук. Для карбонільних сполук характерні реакції нуклеофільного приєднання. Реакції каталізуються кислотами, оскільки протони, приєднуючись до атома оксигену, перетворюють молекулу на карбкатіон:

3. а) Найбільш поширеними реакціями (АN) є:
Утворення напівацеталей та ацеталей. При взаємодії альдегідів з однією або двома молекулами спирту утворюються напівацеталі й ацеталі за механізмом нуклеофільного приєднання. Нуклеофільною частинкою в цих реакціях є гідроксильна група спирту.

Реакції утворення напівацеталю й ацеталю є оборотними, тому легко гідролізуються у кислому середовищі. Кетони в аналогічних умовах кеталей не утворюють. Слід зазначити, що утворення ацеталей часто використовується в органічному синтезі як тимчасовий захист альдегідної групи.
Утворення гідратів. Альдегіди, як найбільш активні представники оксосполук, здатні до приєднання молекули води з утворенням гідратів. Реакція оборотна й стабільні гідрати утворюються тільки з деякими активними альдегідами, наприклад, з формальдегідом:

При розчиненні у воді трихлороцтового альдегіду (хлоралю) утворюється стабільна сполука хлоральгідрат. Хлоральгідрат має наркотичну активність, що і зумовило його застосування в медицині, зі снодійним і протисудомним ефектом.

Утворення імінів. Взаємодія з амінами відбувається за механізмом «приєднання-відщеплення» і складається з двох етапів: на першому етапі реакції приєднується нуклеофільна частка H2N-X (де X = Н, -OH, -NH2, -Alk, -Аг) до позитивно зарядженого карбону карбонільної групи, при цьому подвійний зв'язок у групі C=O розривається:

Відщеплення від термодинамічно нестійкого продукту реакції молекули води (реакція елімінування) з утворенням основи Шиффа відбувається на другому етапі:

У загальному вигляді:

Важливо відзначити, що утворення іміну є необхідною стадією зв'язування молекули ретиналю з білком у біохімічному процесі збудження паличок сітківки ока.
Основи Шиффа можуть бути також інтермедіатами біохімічних реакцій проміжного обміну амінокислот в організмі, наприклад, у процесах трансамінування й відновного амінування α-кетокислот і α-амінокислот.
Альдольна конденсація. Конденсацією називається реакція, яка спричиняє подовження карбонового скелета. Зазвичай у результаті реакції конденсації виділяється молекула води або іншої речовини. Конденсація альдегідів і кетонів називається альдольною конденсацією або альдольним приєднанням.
Наявність рухомого а-гідрогенового атома в молекулі насичених альдегідів і кетонів надає їм здатність вступати в реакцію нуклеофільного приєднання з карбоксильною групою іншої молекули. Це оборотна реакція, каталізатором якої є луг. Важливо відзначити механізм реакції. Гідроксильний іон лугу, відокремлюючи протон від а-карбонового атома, перетворює молекулу на карбаніони:

Карбаніон приєднується подвійним зв’язком у карбонільній групі іншої молекули:

Утворений аніон стабілізується, приєднуючи протон від молекули води:
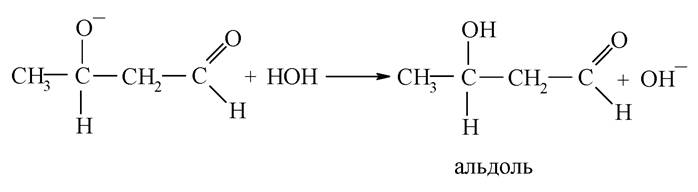
С-Н кислотами можуть бути лише речовини, які мають атом гідрогену у а-вуглецевого атома. Так, бензальдегід, що не має таких атомів, у присутності лугів не утворює альдолю, а вступає в реакцію Канніццаро: самоокиснення й самовідновлення альдегідної групи. У результаті одна молекула відновлюється в бензиловий спирт, а друга окиснюється в бензойну кислоту, утворюючи з лугом сіль:

Аналогічно поводить себе формальдегід, який не має атомів карбону в радикалі:

Реакція альдольної конденсації має велике практичне значення, тому що дозволяє збільшувати довжину карбонового ланцюга. Так, у біохімії для подовження карбонового ланцюга в циклі Кребса відбувається взаємодія щавлевооцтової кислоти з ацетилкоферментом А з утворенням лимонної кислоти.
б) Реакції відновлення і окиснення.
При відновленні альдегідів утворюються первинні спирти:
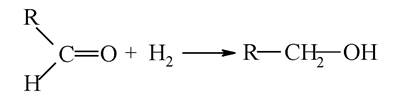
При відновленні кетонів утворюються вторинні спирти:

Відновлення альдегідів і кетонів проводиться за допомогою гідридів металів (LiH, NaH), які вивільняють гідрид-іон Н_, що є нуклеофільною частинкою, яка приєднується за подвійним зв'язком С=О. Інший атом гідрогену (у вигляді іона Н+) поповнюється за рахунок кислоти.
У біохімічних системах відновлення карбонільних сполук з утворенням первинних і вторинних спиртів каталізується ферментами дегідрогеназами, а донорами атомів гідрогену є відновлювальні форми спеціальних коферментів НАД+ (нікотинамідадениндинуклеотид) і НАДФ+ (нікотинамідаденіндинуклеотидфосфат). Реакція відбувається за схемою:
![]()
Реакції окиснення є характерними лише для альдегідів, які при цьому перетворюються на відповідні карбонові кислоти:
![]()
Кетони окиснюються тільки сильними окиснювачами, наприклад, перманганатом калію. При цьому відбувається розрив карбонового ланцюга поряд з карбонільною групою та утворюється дві кислоти:

4. Окиснення альдегідів іонами металів (Ag+ і Cu2+ ) широко використовується в аналітичній практиці, біохімії й фармакології для визначення альдегідів і кетонів.
Реакція «срібного дзеркала» - окиснення альдегідів амоніачним розчином оксиду аргентуму (І) (реактивом Толленса) з виділенням металевого срібла:

Механізм реакції полягає в окисненні альдегіду комплексною сполукою [Ag(NH3)2]OH з утворенням солі амоніаку та відновлення оксиду аргентуму:
![]()
Реакція Троммера з формальдегідом. Сполуки, що містять вільну карбонільну групу, мають здатність відновлювати метали (Ag, Cu, Fe та ін.) у лужному середовищі. При нагріванні розчину формальдегіду з лужним розчином CuSО4 з'являється жовте забарвлення, обумовлене утворенням гідроксиду купруму (І), при цьому альдегід окиснюється:

При подальшому нагріванні жовтий осад набуває червоного кольору за рахунок утворення Cu2O.
Реакція окиснення альдегіду реактивом Фелінга (комплексу оксиду купруму (ІІ) з калієво-натрієвою сіллю винної (виннокам’яної) кислоти). Для приготування реактиву змішують сульфат купруму з лужним розчином калій- натрій тартратом - сегнетовою сіллю, у результаті чого формується тартратний комплекс міді: CuSO4 + 2 NaOH ↔ Cu(OH) 2 + Na2SO4

Реактив Фелінга легко відновлюється альдегідами з утворенням оксиду купруму (І), який випадає у вигляді осаду кольору червоної цегли:

Загальна схема реакції:

5. Формальдегід (мурашиний альдегід) СН2О застосовується як дезинфікуючий і консервуючий реагент для анатомічних препаратів у вигляді 37-40 %-го водного розчину («формалін»). Активована за допомогою специфічних ферментів молекула формальдегіду в комплексі з вітаміном В6 (фолієва кислота) - формілтетрагідрофолат бере участь у біосинтезі пуринового кільця нуклеотидів. Комплекс форміату з амінокислотою метіоніном (N-формілметіоніном) є визначальною біомолекулою, яка ініціює синтез білка в рибосомах мікроорганізмів. У невеликих кількостях формальдегід утворюється в організмі людини як продукт N-дезалкілування багатьох лікарських препаратів у гепатоцитах.
З формальдегіду синтезують уротропін, який застосовують для синтезу полімерів, а також як сечогінний засіб:
![]()
Ацетон (диметилкетон) СН3-СО-СН3 - поширений розчинник та речовина, яка широко застосовується у фармацевтичному синтезі. Ацетон також утворюється в значних кількостях в організмі людини при розщепленні глюкози (гліколіз). При цукровому діабеті спостерігається аномально високий вміст вільного ацетону в крові. Диоксиацетонфосфат ферментативним шляхом перетворюється на свою ізомерну форму - гліцеральдегід-3-фосфат:
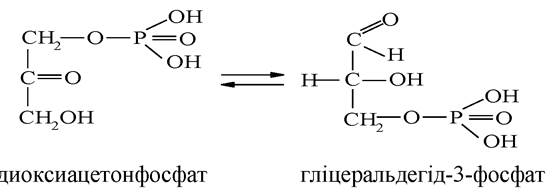
Ацетальдегід (оцтовий альдегід) СН3-СНО - один із центральних інтермедіатів метаболізму в клітині, який у вигляді тіоефіру з коферментом А утворюється при окисненні етилового спирту, у т. ч. як метаболіт ферментативного дегідрування етанолу в організмі.
Альдегіди й кетони в основному є важливими проміжними продуктами обміну речовин, вони утворюються в організмі людини як продукти метаболізму моносахаридів, жирних кислот, амінокислот. Багато альдегідів і кетонів використовують в синтезі ліків.
Виконайте завдання та перевірте правильність їх розв’язання за еталонами відповідей
Завдання № 1
1. Укажіть реакцію утворення іміну:

2. Укажіть рівняння реакції, яке дозволяє отримати напівацеталь:

Еталони відповідей: 1-В, 2-В.