Основи біоорганічної хімії (навчальний посібник) - Г. О. Сирова - 2018
Тема
Структура, властивості й біологічне значення карбонових кислот
Актуальність теми. Медико-біологічне значення карбонових кислот полягає в тому, що багато які з них є метаболітами і наявні в різних рослинних і тваринних організмах. Оцтова кислота і її похідні - ацетати -являють собою структурну одиницю, з якої побудовано багато складних біомолекул, наприклад, стероїдні гормони, ліпіди та ін. Карбоксильна група входить до складу таких важливих груп біомолекул, як гідрокси-, кето- і амінокислоти.
У цілому, у живих організмах найрізноманітніші органічні речовини (вуглеводні, спирти, альдегіди) зазвичай зазнають ферментативного окиснення до відповідних карбонових кислот.
Загальні цілі:
- вивчити склад, будову, властивості та біологічну роль карбонових кислот і їх функціональних похідних;
- уміти використовувати знання властивостей функціональних груп для прогнозування особливостей хімічної поведінки карбонових кислот і їх похідних, які є метаболітами в процесі обміну речовин.
Конкретні цілі
1. Уміти пояснити залежність хімічної та біологічної активності карбонових кислот від електронної та просторової будови молекул.
2. Уміти інтерпретувати механізми реакцій, характерних для карбонових кислот.
3. Уміти пояснити біологічну роль карбонових кислот та їхніх похідних у процесах життєдіяльності.
Теоретичні питання
1. Класифікація карбонових кислот.
2. Електронна будова карбоксильної групи.
3. Реакції солеутворення.
4. Реакції нуклеофільного заміщення:
- реакція етерифікації, тіоефіри;
- утворення галогенангідридів та ангідридів кислот;
- утворення амідів.
5. Декарбоксилювання кислот.
1. Карбонові кислоти — похідні вуглеводнів, які мають у своєму складі карбоксильну групу: -СООН. Загальна формула: R-СООН. Залишок кислоти без гідроксилу - «ацил»:
За кількістю карбоксильних груп кислоти поділяються на:
- монокарбонові кислоти (одноосновні), наприклад:
НСООН - мурашина (метанова);
СН3СООН - оцтова (етанова);
СН3СН2СООН - пропіонова (пропанова);
СН3(СН2)2СООН - масляна (бутанова);
СН3(СН2)3СООН - валеріанова (пентанова);
СН3(СН2)4СООН - капронова (гексанова);
СН3(СН2)5СООН - енантова (гептанова).
- дикарбонові, наприклад:
НООС-СООН - щавлева (етандіова);
НООС-СН2 - СООН - малонова (пропандіова);
НООС-(СН2)2 - СООН - янтарна (бутандіова);
НООС-(СН2)3 - СООН - глутарова (пентандіова).
- трикарбонові, наприклад: НООС-СН2-С(СООН)(ОН)-СН2-СООН - лимонна (3-гідрокси-3-карбоксипентандіова) кислота.
За будовою вуглеводневого радикала:

- аліфатичні: за наявністю або відсутності подвійного зв'язку у карбоновому ланцюгу - можуть бути насиченими або ненасиченими
- акрилова (проп-2-енова), кротонова (бут-2-енова);
- ароматичні: бензойна;
- гетероциклічні: нікотинова (β-піридинкарбонова).
Карбонові кислоти, які входять до складу ліпідів, майже всі містять парне число карбонових атомів і нерозгалужений карбоновий ланцюг. Найбільш важливими жирними кислотами є:
Найпоширеніші кислоти - олеїнова і пальмітинова - містяться в усіх досліджених жирах. Деякі ненасичені кислоти (лінолева, ліноленова) є незамінними і не можуть синтезуватися в організмі, вони повинні надходити в організм з їжею.
Вуглеводневі радикали насичених кислот знаходяться в енергетично найбільш вигідній зиґзаґоподібній конформації.
Подвійні зв'язки в молекулах ненасичених кислот є ізольованими.

У цьому випадку зигзагоподібна конформація переривається пласкими ділянками. При цьому можливе цис- і транс- розташування вуглеводневих частин:

У природних вищих ненасичених кислотах здійснюється енергетично менш вигідна цис-форма, оскільки це призводить до більш компактного упакуваня вуглеводневих радикалів у ліпідах.
Заміна цис-ізомерів ненасичених карбонових кислот на транс-ізомери, можлива при штучному одержанні жирів, спричиняє негативні фізіологічні наслідки. Дослідження американських вчених показали, що використання як продукту харчування маргарину, багатого на транс-ізомери жирних кислот, збільшує смертність від ішемічної хвороби серця, а також кількість інфарктів міокарда.
Для багатьох карбонових кислот найбільш уживаними є тривіальні назви, виникнення яких зазвичай пов'язано з природним джерелом, з якого вони виділені або синтезовані. Так, мурашина кислота міститься у виділеннях мурашок, масляна - у коров'ячому маслі, щавлева - у деяких рослинах і т. ін.
Кислотні залишки, які називають ацильними радикалами, також характеризуються своїми індивідуальними назвами з використанням суфікса -іл: форміл - залишок мурашиної кислоти, ацетил - оцтової, пропіоніл - пропанової, бутирил - бутанової, бензоїл - бензойної.
Карбонові кислоти належать до висококиплячих і високоплавких речовин порівняно з іншими органічними сполуками з тим самим числом атомів карбону. Це пояснюється утворенням асоціатів за рахунок утворення водневого зв'язку між киснем карбонільної групи і гідрогеном гідроксилу.
2. Хімічні властивості карбонових кислот визначаються особливостями будови карбоксильної групи, яка являє собою не формальну комбінацію спиртової та карбонільної груп, а нове функціональне угруповання. Тому кислоти принципово відрізняються за властивостями, як від спиртів, так і від оксосполук. З одного боку, електронегативний атом оксигену ОН-групи знижує полярність зв'язку групи С=О, тому для карбонових кислот не є характерним нуклеофільне приєднання за цим зв'язком, властивим для оксосполук. З іншого боку, позитивно заряджений карбонільний атом карбону притягує до себе електронні пари кисню ОН-групи і в такий спосіб послаблює зв'язок ОН, посилюючи позитивний заряд на атомі гідрогену. Тому карбонові кислоти мають більш сильні кислотні властивості, ніж спирти.

У карбоксильній групі наявне р,π-спряження, унаслідок чого гідроген значною мірою протонований:

Карбоксилат-іон, який утворюється після відщеплення Н+, являє собою термодинамічно стійку трицентрову спряжену систему:

3. Ступінь кислотності (сила кислоти) залежить від будови вуглеводневого радикала і наявності замісників з електронодонорними або електроноакцепторними властивостями. Наприклад, хлорзаміщені кислоти внаслідок негативного індуктивного ефекту хлору мають велику кислотність, ніж незаміщені. Позитивним індуктивним ефектом алкілрадикалу пояснюється зменшення кислотності в гомологічному ряду одноосновних карбонових кислот:
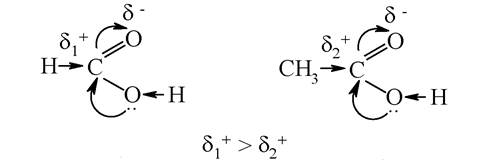
Двохосновні карбонові кислоти, оксокислоти, гідроксикислоти більш сильні кислоти, ніж монокарбонові:

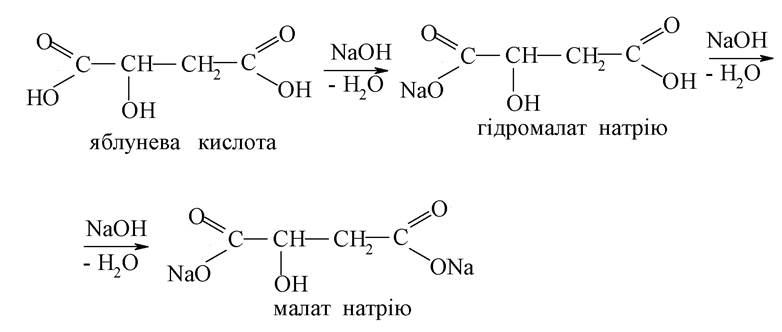
Кислотні властивості карбонових кислот у хімічних і біохімічних системах проявляються в реакціях солеутворення. Відрив протона від другої карбоксильної групи ускладнений, тому часто в біохімічних системах дикарбонові кислоти утворюють два типи солей - кислі і середні:
Окиснювально-відновні перетворення кислот мають складний перебіг. На них діють тільки сильні відновники, а окиснюються порівняно легко лише мурашина (за рахунок альдегідної групи) і щавлева. Ферментативним шляхом кислоти окиснюються за а- і Р-карбоновим атомом до α- і β-гідроксикислот.
4. Наявність спряження всередині функціональної групи спричиняє те, що реакції нуклеофільного приєднання за карбонілом неможливі. Однак нуклеофільне заміщення -ОН групи можливе, унаслідок впливу карбонільного оксигену й виникнення часткового позитивного заряду на карбоні карбоксилу.
Такі реакції протікають або за наявності досить сильного нуклеофілу, або в умовах кислотного каталізу, оскільки частковий позитивний заряд на карбонільних атомах карбону виявляється недостатнім для атаки його нуклеофілом.
Характерними для карбонових кислот типами реакцій нуклеофільного заміщення (заміщення ОН-груп) з утворенням відповідних біологічно важливих функціональних похідних є такі:
Утворення естерів (складних ефірів). Реакції естерифікації здійснюються при нагріванні органічної кислоти зі спиртом у присутності мінеральної кислоти. Реакція проходить за механізмом нуклеофільного приєднання- відщеплення і може розглядатися як процес ацилювання спирту кислотою.
Механізм реакції включає такі стадії: протонування кислоти, нуклеофільна атака катіона спиртом, відщеплення молекули води, депротонізація естеру:

Складні ефіри нижчих спиртів і кислот при звичайній температурі є рідинами, вищих - твердими речовинами.
Найважливішою властивістю складних ефірів є їх гідроліз, який може бути представлений як в кислому, так і в лужному середовищі. Механізм гідролізу в кислому середовищі може бути представлений реакціями, зворотними процесу етерифікації. Гідроліз в лужному середовищі незворотній внаслідок утворення стійкого ацилат-іона:

Сірковмісними аналогами складних ефірів є тіоефіри карбонових кислот - продукти взаємодії кислот з тіолами:

Серед тіоефірів є важливі в біологічному відношенні речовини, зокрема, ацетилкофермент А - тіоефір оцтової кислоти й коферменту А. Кофермент А утворений трьома компонентами: аденозиндифосфатом (АДФ), пантотеновою кислотою (вітамін В3) і 2-аміноетантіолом:

Кофермент А активує карбонові кислоти, перетворюючи їх на реакційноздатні ефіри тіолів:

Ацильні похідні коферменту А мають велику реакційну здатність до нуклеофільного заміщення. Це обумовлено великим порівняно зі складними ефірами частковим позитивним зарядом на карбонільному вуглеці (+М ефект -S-R групи менший, ніж -O-R). Тому ацетил-КоА може слугувати ацилюючим агентом:

Зокрема, за його участі здійснюється перетворення холіну на ацетилхолін:

Сполуки, побудовані на зразок складних ефірів, складають обширний клас біологічно активних речовин - омилюваних ліпідів, а реакція естерифікації є ключовою при біосинтезі ліпідів.
Утворення галогенангідридів та ангідридів кислот:

Галогенангідриди карбонових кислот використовуються як ацилюючі засоби при одержанні, наприклад, амідів кислот, у том числі, ті які застосовуються як лікарські препарати.
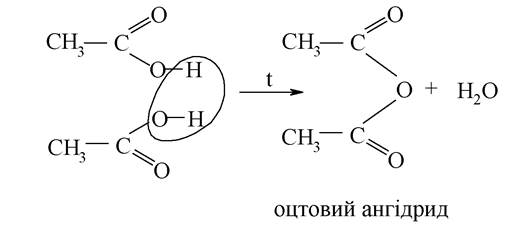
Ангідриди кислот - потужні ацилюючі агенти.
У біохімічних процесах велике значення має утворення змішаних ангідридів карбонових і мінеральних кислот:

Заміщені ацилфосфати є метаболітами, за участю яких в організмі відбувається перенос ацил-груп до гідроксильних, тіольних і аміно-груп різних сполук.
Утворення амідів. Аміди утворюються в результаті заміщення ОН-групи карбоксилу на аміно-групу при взаємодії таких похідних карбонових кислот, як галогенангідриди, ангідриди, складні ефіри з амоніаком або амінами:

У реакції утворення амідів у біохімічних системах вступають різні похідні карбонових кислот, зокрема а-амінокислоти при біосинтезі білків і пептидів.
5. Реакція декарбоксилювання - одна з найбільш важливих в біохімії реакцій карбонових кислот, особливо α- і β-оксокислот, а також α-амінокислот в організмі під дією ферменту декарбоксилази.
Незаміщені монокарбонові кислоти декарбоксилюються надзвичайно важко, а за наявності електроноакцепторного замісника при α- або β- карбоновому атомі ця реакція полегшується:

Наведений приклад - ілюстрація процесу, який має місце в організмі хворих на цукровий діабет.
Виконайте завдання та перевірте правильність їх розв’язання за еталонами відповідей
Завдання № 1
1. Наведіть електронну будову карбоксильної групи. Поясніть вплив на кислотність електронодонорних і електроноакцепторних замісників у вуглеводневому радикалі кислот. Яка з кислот найбільш сильна?
А. Пропіонова. В. Молочна. С. Піровиноградна.
2. Яка зі сполук легше декарбоксилюється? Чому? Напишіть рівняння реакції:
А. Масляна (бутанова). В. Ацетооцтова (3-оксобутанова).
3. До якого типу належить реакція утворення хлорангідриду карбонової кислоти? Опишіть механізм реакції нуклеофільного заміщення у тригонального атома карбону. Напишіть рівняння реакції утворення хлорангідриду оцтової кислоти. Чим пояснюється більш висока реакційна здатність хлорангідридів кислот порівняно з кислотами в реакціях нуклеофільного заміщення?
A. Нуклеофільного приєднання.
B. Нуклеофільного заміщення.
C. Електрофільного заміщення.
Еталони відповідей: 1 - С; 2 - В; 3 - В.