БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
Основу жизнедеятельности любого организма составляют химические процессы. Практически все реакции в живом организме протекают с участием природных биокатализаторов, называемых ферментами, или энзимами. Среди множества энергетически возможных реакций ферменты избирательно преобразуют реагенты, называемые субстратами, по физиологически полезному пути. Таким образом, ферменты управляют всеми метаболическими процессами организма.
В научной литературе на русском языке утвердились оба термина: «ферменты» и «энзимы», но предпочтение отдают термину «фермент», хотя наука о ферментах называется энзимология. Слово «фермент» происходит от лат. fermentum — закваска, а «энзим» — от греч. еn — в, внутри и zyme — дрожжи. Данная терминология возникла исторически при изучении ферментативных процессов спиртового брожения.
Становление энзимологии как науки произошло в начале XIX века. Активное её развитие продолжается до настоящего времени. В задачи этой науки входят определение роли отдельных ферментов в ускорении химических реакций, протекающих в организме, выделение и очистка ферментов, установление их структуры, исследование механизма действия, изучение кинетических характеристик и особенностей регуляции активности in vivo.
Для практической медицины важность энзимологии обусловлена тем, что она даёт фармакологам инструмент направленного изменения метаболизма клетки путём воздействия определёнными химическими веществами на активность ферментов. Огромное количество фармацевтических препаратов — ингибиторы ферментов. Другая, не менее важная задача энзимологии для практической медицины — использование методов определения активности ферментов в биологических жидкостях для диагностики заболеваний. Кроме того, выделенные и очищенные ферменты могут использоваться в качестве терапевтических средств.
I. Общая характеристика ферментов как биологических катализаторов
Ферменты, как было установлено ещё в 1922 г., являются белками. Их роль уникальна: они увеличивают скорость протекания химической реакции, однако при этом не расходуются. В 1926 г. был впервые очищен и выделен в виде белковых кристаллов фермент уреаза, катализирующий реакции расщепления мочевины до аммиака и диоксида углерода. К настоящему времени в кристаллическом виде получены сотни различных ферментов, расшифрованы их аминокислотные последовательности, изучается их роль в метаболических превращениях.
В роли биокатализаторов могут выступать и небелковые соединения. Например, некоторые типы РНК вызывают гидролиз фосфодиэфирных связей нуклеиновых кислот. Такие молекулы РНК с каталитической активностью называют рибозимами, однако их значение в химическом превращении соединений намного меньше, чем у ферментов.
Поскольку ферменты — белковые молекулы, следовательно, они обладают всеми свойствами, характерными для белков. В то же время они имеют особенности строения, характеризующие их как катализаторы. Рассмотрим основные свойства ферментов как биологических катализаторов.
А. Специфичность
Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут «перекрываться» (рис. 2-1).
Рис. 2-1. Строение активного центра фермента. А - присоединение субстрата к ферменту в активном центре; Б - положение аминокислотных остатков, формирующих активный центр фермента, в первичной структуре белка; В - активный центр фермента условно разделяется на участок связывания и каталитический участок. Участок связывания представлен радикалами аминокислот, функциональные группы которых обеспечивают связывание субстрата. Каталитический участок образован радикалами аминокислотных остатков, функциональные группы которых обеспечивают химическое превращение субстрата.

В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается) с ферментом, формируя фермент-субстратный комплекс. В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента. Схематично процесс катализа можно представить следующим уравнением:
Е + S <-> ES <-> ЕР <-> Е + Р,
где Е — фермент (энзим), S — субстрат, Р — продукт. Данные обозначения общеприняты и происходят от английских слов enzyme, substrat, product.
Специфичность — наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра (рис. 2-2).
Рис. 2-2. Функциональная значимость отдельных участков активного центра фермента.

1. Субстратная специфичность
Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
✵ абсолютную субстратную специфичность;
✵ групповую субстратную специфичность;
✵ стереоспецифичность.
Абсолютная субстратная специфичность
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало.
Пример фермента с абсолютной субстратной специфичностью — аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина:

Другой пример фермента с абсолютной субстратной специфичностью — уреаза, катализирующая гидролиз мочевины до диоксида углерода и аммиака.

Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов.
Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира (см. схему).
Схема

Большинство протеолитических ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфичность, гидролизуя пептидные связи, образованные разными аминокислотами.
Стереоспецифичность
При наличии у субстрата нескольких стереоизомеров фермент проявляет абсолютную специфичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам.
Стереоспецифичность к D-сахарам. Большинство моносахаридов и продуктов их обмена в организме человека и других млекопитающих относят к D-стереоизомерам. Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.

Стереоспецифичность к L-аминокислотам. Белки человека состоят из аминокислот L-ряда. Большинство ферментов, обеспечивающих превращение аминокислот, имеет стереоспецифичность к L-аминокислотам.
Стереоспецифичность к цис-транс-изомерам. Фермент фумараза оказывает действие только на фумарат. Малеинат (цис-изомер фумарата) не является субстратом фумаразы.

Исключение составляют только ферменты эпимеразы (рацемазы), катализирующие превращение оптических изомеров.
Стереоспецифичность к α- и β-гликозидным связям. Фермент амилаза действует только на α- гликозидные связи, что позволяет гидролизовать крахмал и гликоген (полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями. Целлюлоза — также полимер глюкозы, однако остатки глюкозы в нём связаны β-гликозидными связями. В результате отсутствия у человека ферментов, специфичных к β-гликозидной связи, целлюлоза не гидролизуется в кишечнике человека и не может служить источником глюкозы.
2. Каталитическая специфичность
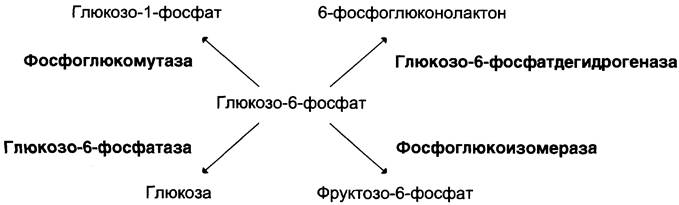
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения. Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека — субстрат 4 различных ферментов: фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатде- гидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов (см. схему ниже).
Б. Каталитическая эффективность
Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 108 — 1014 раз быстрее, чем некатализируемые реакции. Каждая молекула фермента способна за секунду трансформировать от 100 до 1000 молекул субстрата в продукт.
Количество молекул субстрата, превращённых в продукт с помощью одной молекулы фермента за 1 с, называют числом оборотов фермента, или молярной активностью.
В. Лабильность ферментов
Каталитическая эффективность фермента, как и любой белковой молекулы, зависит от его конформации, и в частности от конформации активного центра.
Для ферментов характерна конформационная лабильность — способность к небольшим изменениям нативной конформации вследствие разрыва слабых связей. Поэтому воздействие денатурирующих агентов, способных изменять конформацию молекулы фермента, приводит к изменению конформации активного центра и снижению способности присоединять субстрат. В результате этого уменьшается каталитическая эффективность фермента.
Г. Способность ферментов к регуляции
Активность ферментов в клетке зависит от количества молекул субстрата, продукта, наличия кофакторов и коферментов. Действие ферментов в клетке, как правило, строго упорядочено: продукт одной ферментативной реакции является субстратом другой, образуя таким образом «метаболические пути». Среди множества ферментов практически каждого метаболического пути различают ключевые, или регуляторные, ферменты, активность которых может изменяться в зависимости от потребности клетки в конечном продукте метаболического пути. Регуляторные ферменты расположены, как правило, в начале и/или в месте разветвления метаболического пути. Они катализируют либо самые медленные (скорость-лимитирующие реакции), либо необратимые реакции. Подробно о том, как осуществляется контроль метаболизма путём регуляции активности ферментов, описано в подразделе VII.