БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
II. Классификация и номенклатура ферментов
Каждый фермент имеет 2 названия. Первое — короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) — систематическое, применяемое для однозначной идентификации фермента.
А. Рабочее название
В названии большинства ферментов содержится суффикс «аза», присоединённый к названию субстрата реакции, например, уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например, лактатдегидрогеназа, аденилатциклаза, фосфоглюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например, трипсин, пепсин, ренин, тромбин.
Б. Классы ферментов
Международный союз биохимии и молекулярной биологии в 1961 г. разработал систематическую номенклатуру, согласно которой все ферменты разбиты на 6 основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов с учётом преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т. д. Каждый из 6 классов имеет свой порядковый номер, строго закреплённый за ним.
1. Оксидоредуктазы
Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой).
Систематическое наименование ферментов составляют по формуле «донор: акцептор — оксидоредуктаза», рабочее — субстрат — подкласс оксидоредуктаз.
Дегидрогеназы. В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN (см. ниже). Все ферменты этой группы обладают высокой субстратной специфичностью. Пример реакции:

Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
![]()
Оксигеназы (гидроксилазы) — атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции:
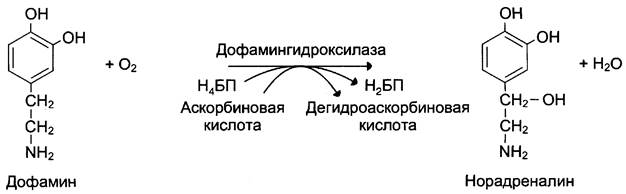
2. Трансферазы
Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы.
Название этих ферментов составляют по формуле «донор: акцептор— транспортируемая группа- трансфераза». К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы). Примеры реакций (см. схему А).
3. Гидролизы
Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи.
Наименование ферментов составляют по формуле «субстрат—гидролаза» или прямым присоединением к названию субстрата суффикса «аза», например, протеаза, липаза, фосфолипаза, рибонуклеаза. Пример реакции (см. схему Б).
Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определённой химической связи: эстеразы, фосфатазы и др.
4. Лиазы
К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NН2, SН2 и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
Наименование ферментов составляют по формуле «субстрат—отщепляемая или присоединяемая группировка». Примеры реакций (см. схему В).

5. Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
Как общее название ферментов этого класса применяют термин «изомеразы», например, (см. схему А).
Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы (см. схему Б).
Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют «мутазой», например, (см. схему В).
6. Лигазы (синтетазы)
Катализируют реакции присоединения друг к другу двух молекул с образованием ковалентной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют лигазами, или синтетазами (см. схему Г).
В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами (см. схему на с. 83).

Схема

В. Систематическое название
В соответствии с классификацией каждый фермент получил систематическое название, однозначно характеризующее катализируемую им химическую реакцию. Например, D-глицеральдегид-3-фосфат: NAD — оксидоредуктаза (рабочее название — глицеральдегидфосфат дегидрогеназа). Из названия фермента следует, что субстратом этого фермента служит D-глицеральдегид-3-фосфат, тип катализируемой реакции — окислительно-восстановительная в присутствии кофермента NAD+.
В 1972 г. комиссией по номенклатуре биохимических соединений Международного союза теоретической и прикладной химии были предложены «Правила номенклатуры ферментов», имеющие кодовое четырёхзначное цифровое обозначение, где первая цифра обозначает класс фермента, вторая цифра (подкласс) уточняет преобразуемую группировку, третья (подподкласс) — уточняет дополнительных участников реакции (например, донора и акцептора) и четвёртая — порядковый номер фермента в данной подгруппе. Так, фермент малатдегидрогеназа имеет систематическое название L-малат: NAD- оксидоредуктаза и кодовый шифр 1.1.1.38. Шифр означает, что этот фермент относят к первому классу ферментов — оксидоредуктаз, окисляемая группа — гидроксильная группировка (1) в присутствии кофермента NAD+ (1) и порядковый номер фермента в этой подгруппе — 38. Кодовую номенклатуру ферментов в основном используют в научной литературе.