БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.10.Біосинтез білка
6.10.5. Ініціація трансляції. Особливості процесу ініціації у прокаріотів і еукаріотів
Першим рибосомним етапом матричного синтезу поліпептиду є ініціація трансляції. У ході синтезу білка декодування мРНК проходить у напрямку від 5'- до З'-кінця, забезпечуючи синтез пептиду від N- до С-кінця молекули, що було доведено в 1961 р. Х. Дінцісом.
Фундаментальна функція ініціації трансляції - це безпомилкове знаходження рибосомою ініціаторного кодону, що визначає старт і рамку зчитування мРНК. Друга функція - уведення донорного субстрату в Р-центр рибосоми, оскільки для проходження наступного елементарного акту елонгації - продовження поліпептидного ланцюга - пептидильний центр має бути задіяним у процесі трансляції. Третім важливим аспектом є ключова роль механізму ініціації в регуляції біосинтезу білка на рівні трансляції. Саме ініціація є основною регуляторною стадією біосинтезу білка, яка визначає інтенсивність трансляції різних мРНК, її зупинку за дії різноманітних внутрішньоклітинних сигналів, або індукцію трансляції "мовчазних" мРНК. Крім того, різні швидкості трансляції на різних мРНК визначають необхідні співвідношення продукції білків в організмі. Для виконання цих функцій необхідні 30(40)S+50(60S)→ 70(80)S рибосоми, ініціаторна аміноацил-тРНК, ініціаторні кодони у складі мРНК, білкові фактори ініціації та ГТФ. Процеси ініціації трансляції у про- та еукаріотів у цілому подібні, хоча складність функціонування матричних синтезів в еукаріотів позначається на роботі їхнього трансляційного апарату.
Ініціація у прокаріотів. Трансляція природних мРНК починається з кодонів АУГ або ГУГ. Як правило, ініціаторним кодоном найчастіше є АУГ, а першою амінокислотою на N-кінці поліпептиду - метіонін. У всіх організмах є дві різні Мет-тРНКМет, одна з яких ініціаторна, друга - акцептує метіонінові залишки та включає їх на етапі елонгації. Метіоніл-тРНК-синтетаза в обох випадках та сама. Метіонін, котрий включається на етапі ініціації, у прокаріотів формільований (рис. 6.37, 1).
Процес утворення формілметіоніл-тРНКфМет (рис. 6.37, 2) проходить у два етапи. Спочатку за участю відповідної аміноацил-тРНК- синтетази метіонін приєднується до тРНКФ1^. На наступній стадії трансформілаза переносить формільну групу від №°-формілтетрагідрофолієвої кислоти на аміногрупу метіоніну з формуванням фМет-тРНКфМет. Трансформілаза є більш специфічним ферментом, ніж метіоніл-тРНК-синтетаза, оскільки каталізує процес за участю тільки тРНКфМет, розпізнаючи певні структурні характеристики її молекули. Особливості первинної, вторинної та навіть третинної будови ініціаторних аміноацил-тРНК приводять до взаємодії з білковими факторами ініціації, що сприяє їхньому подальшому розміщенню виключно в Р-центрі рибосоми. Отже, процес формі- лювання має важливий хімічний і біологічний сенс: за рахунок блокування NH2-групи метіоніну синтез білка проходить у напрямку NH2 → СООН, а формілметіоніл-тРНКфМет допомагає мРНК знайти на 30S субодиниці те місце розташування, яке забезпечує трансляцію інформації у вигляді послідовного включення амінокислотних залишків у білкову молекулу. При процесингу білкової молекули формільна група може бути видаленою під впливом дефор- мілази, а метіоніновий залишок відщеплюється в деяких випадках за участю метіонінамінопептидази.
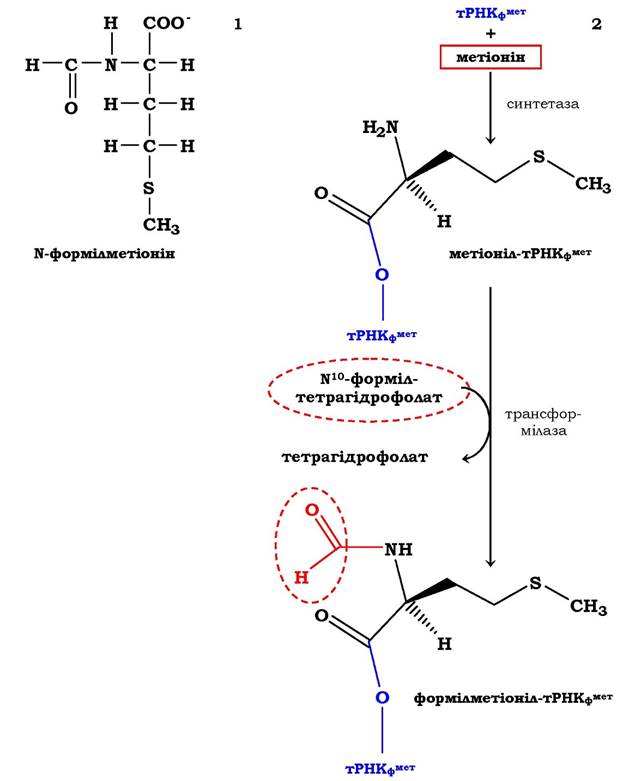
Рис. 6.37. Схема синтезу N-формілметіоніл-тРНК у прокаріотів
Дослідженнями Дж. Шайна і Л. Дальгарно було встановлено, що стартовому кодону 5'-АУГ передує універсальна структура - поліпуринова послідовність (3-9 нуклеотидів, наприклад ААГГАГ), яка характерна рибосомозв'язувальним ділянкам прокаріотичних мРНК і є комплементарною поліпіримідиновій послідовності, розташованій на 3'-кінці молекули 16S рРНК. Цю структуру назвали послідовністю Шайно-Дальгарно (рис. 6.38). Таким чином, за рахунок уотсон- кріківських взаємодій стабілізується положення мРНК у центрі зв'язування 30S субодиниці прокаріотичної рибосоми (рис. 6.39).
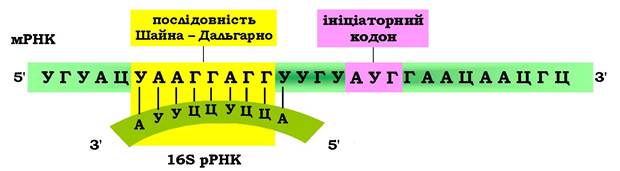
Рис. 6.38. Стабілізація ініціаторного прокаріотичного комплексу
Взаємодія мРНК (послідовність Шайна - Дальгарно) з 16S рРНК (поліпиримідинова послідовність)
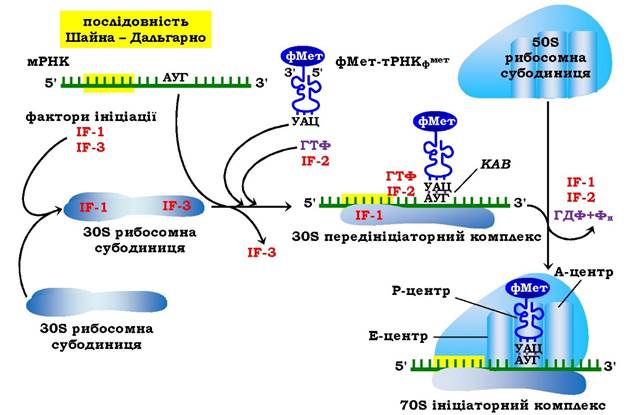
Рис. 6.39. Ініціація синтезу білка у прокаріотів
КАВ - кодон-антикодонова взаємодія
Ініціація трансляції у прокаріотів відбувається за участю трьох білкових факторів, а саме: IF-1, 2, 3 (від англ. Initiation Factors - фактори ініціації) з молекулярними масами відповідно 9·103 ; 95·103та 22·103. IF-1 бере участь у процесах дисоціації рибосом- них субодиниць і стабілізації зв'язків 30S субодиниці з іншими білковими факторами та фМет-тРНКфМет, попереджає зв'язування аміноацил-тРНК з А-центром рибосоми. IF-3 запобігає передчасній асоціації 30S із 50S субодиницею і сприяє залученню IF-2, а також вірній постановці фМет-тРНКфМет та ініціаторного кодону в Р-центр рибосоми. IF-2 є головним білковим фактором ініціації, він має високу спорідненість до ГТФ, утворюючи з ним комплекси, взаємодіє з фМет-тРНКфМет і 30S субодиницею рибосоми та вважається фактором стабілізації всього ініціаторного комплексу.
Утворення прокаріотичного ініціаторного 70S комплексу. На першому етапі за участю IF-1 відбувається приєднання IF-3 до 30S субодиниці. Потім комлементарна взаємодія послідовності Шайна - Дальгарно в мРНК з відповідними ділянками в 16SрРНК сприяє розміщенню стартового кодону АУГ у Р-центрі рибосоми. На наступному етапі до комплексу IF-1, IF-3, мРНК, 30S субодиниця надходять фМет-тРНКфМет-^-2-ГТФ, відбувається кодон-антикодонова взаємодія в Р-центрі рибосоми. На третьому етапі до комплексу приєднується 50S субодиниця, що приводить до гідролізу ГТФ до ГДФ і ортофосфату завдяки ГТФа- зній активності IF-2, вивільнення білкових факторів ініціації та утворення прокаріотичного 70S ініціаторного комплексу. Енергія, яка виділяється при гідролізі ГТФ, направлена на стабілізацію ініціаторного 70S комплексу. Рибосома із заповненим Р-центром і вільним А-центром налаштована до вступу в елонгаційний процес (рис. 6.39).
Для прокаріотів характерна внутрішня ініціація. У цьому випадку мала рибосомна субодиниця асоціює безпосередньо з локальною структурою мРНК, яка містить ініціаторний кодон, незалежно від 5'-кінця мРНК і його віддаленості від початку кодуючої послідовності. Оскільки у прокаріотів часто один довгий поліпептидний ланцюг мРНК містить декілька кодуючих послідовностей для різних білків (поліцистронні мРНК), то такий спосіб забезпечує ініціацію трансляції відразу декількох кодуючих послідовностей усередині такої мРНК незалежно одна від одної.
Ініціація трансляції в еукаріотів. Набагато складніше процес ініціації проходить в еукаріотів, у яких мала рибосомна субодиниця, як правило, спочатку приєднується до 5'-кінця мРНК, а потім рухається вздовж ланцюга мРНК і сканує його, поки не зустріне ініціаторний кодон. Найбільші відмінності в процесах трансляції про- та еукаріотів спостерігаються саме на етапі ініціації. мРНК еукаріотів має складну вторинну структуру, збагачену шпилькоподібними спіралізованими на себе ділянками, містить модифіковані 5'- і З'-кінці (кеп на 5'-кінці та полі(А)-хвіст на З'-кінці), утворює комплекси з РНК-зв'язувальними білками (інформосоми). Ініціаторна метіоніл-тРНК у еукаріотів не формільована й має ряд структурних особливостей порівняно з елонгаційною Мет-тРНКМет. В еукаріотів значно більша кількість білкових факторів ініціації -eIF (від англ. Eukaryotic Initiation Factors - фактори ініціації еукаріотів).
Білкові фактори ініціації еукаріотів поділяються на дві основні групи:
✵ що зв'язані з мРНК і готують її до процесу ініціації: гетеромультимерний комплекс eIF-4F (eIF-4A, eIF-4E, eIF-4G) та eIF-4B;
✵ які взаємодіють з рибосомними субодиницями, опосередковуючи їхню асоціацію/дисоціацію, а також зв'язування з ініціаторною Мет-тРНКіМет і мРНК: eIF-1, eIF-2, eIF-З, eIF-5, eIF-6.
Структурні особливості та функції основних білкових факторів ініціації еукаріотів (за Б. Негруцьким) наведено в табл. 6.9.
Отже, підготовка еукаріотичної мРНК до інціціації відбувається поетапно: elF-4Е зв'язується з кепструктурою на 5'-кінці мРНК; elF -4В формує комплекс за участю eIF-4A, індукуючи його РНК- залежну хеліказну активність - розплітання вторинної структури 5'-кінця мРНК з використанням енергії гідролізу АТФ; eIF-4G координує роботу всіх факторів. Одночасно потрійний комлекс - ініціаторна Мет-тРНКіМет разом з eIF-2'ГТФ і 40S субодиницею за участю факторів eIF-1 (1А) утворює 43S передініціаторний комплекс, який, у свою чергу, з'єднуюючись (eIF-З) із підготовленою до ініціації мРНК, стабілізує утворення 48S передініціаторного комплексу. Таким чином, постановкою 40S субодиниці на 5'-кінець мРНК розпочинається АТФ-залежне сканування некодуючої ділянки матриці з метою пошуку стартового кодону, енергія гідролізу АТФ витрачається на подолання ділянок спіралізації в нетранслюючій області мРНК. Після знаходження початку кодуючої послідовності відбувається кодон-антикодонова комплементарна взаємодія між АУГ і антикодоном у складі Мет-тРНКіМет; спостерігаються конформаційні перебудови комплексу.
Таблиця 6.9
Фактори ініціації еукаріотів
Назва факторів |
Молекулярна маса, кДа |
Молекулярна маса субодиниць, кДа |
Функція |
|
eIF-1 |
14 |
Стимулює зв'язування 40Sрибосомної субодиниці з 5'-кінцем мРНК. |
||
eIF-1A |
17 |
Стимулює зв'язування Мет-тРНК із 40S субодиницею, стабілізує зв'язування 40S з мРНК. |
||
eIF-2 |
α 36 β 38 γ 52 |
Стимулює ГТФ-залежне зв'язування Мет- тРНК із 40Sсубодиницею; α бере участь у регуляції активності eIF-2 за рахунок її фосфорилювання по серину 51; β взаємодіє з факторами eIF-2B і eIF-5; γ стимулює зв'язування ГТФ із Мет-тРНК. |
||
eIF-2B |
272 |
81, 71, 58, 43, 34 |
Стимулює ГДФ/ГТФ обмін у молекулі eIF-2. |
|
eIF-3 |
550 |
110, 67, 42, 40, 36, 35 |
Зв'язується із 40S субодиницею, стабілізує Мет-тРНК і запобігає асоціації з 60S субодиницею. |
|
eIF-4F |
eIF-4E |
25 |
5'-кеп-мРНК-зв'язувальний білок. |
|
eIF-4G |
220 |
Підсилює зв'язування eIF-4E з 5'-кепом мРНК, координує всі білкові фактори ініціації. |
||
eIF-4A |
46 |
АТФ-залежна хеліказна функція, необхідна для зв'язування рибосоми з еукаріотичною мРНК. |
||
eIF-4B |
69 |
РНК-зв'язувальний білок, який стимулює зв'язування рибосоми з мРНК і подальше її сканування. |
||
eIF-5 |
150 |
Бере участь у гідролізі ГТФ, зв'язаного з eIF-2 на 40Sсубодиниці, полегшує дисоціацію eIF-3. |
||
eIF-6 |
26 |
Сприяє дисоціації 60S субодиниці від інактивованої 80S рибосоми. |
||
Подальше приєднання 60S субодиниці з утворенням 80S еукаріотичного ініціаторного комплексу супроводжується гідролізом ГТФ, зв'язаного з eIF-2, що опосередковується eIF-5 і eIF-2В. Після дисоціації всіх факторів ініціації формується 80S рибосома з Р-центром, який містить АУГ-кодон мРНК, з'єднаний з відповідним антикодо- ном Мет-тРНКіМет. Отже, задіяний Р-центр рибосоми з наявним вільним А-центром свідчить про готовність еукаріотичного рибосом- ного апарату до входження в активний елонгаційний етап.
Складність процесу ініціації в еукаріотів пов'язана також із залученням полі(А)-послідовності на З'-кінці мРНК до утворення ініціаторного комплексу за рахунок взаємодії з 5'-кінцем мРНК. Ця структура стабілізується полі(А)-зв'язувальними білками - РАВР (від англ. роlу - A binding protein), які мають спорідненість до факторів ініціації - кепзв'язувальних білків eIF-4G та eI-4Е, що сприяє зближенню у просторі обох кінців мРНК (рис. 6.40). Така псевдозамкнена форма еукаріотичної мРНК є ефективною для залучення ініціаторних комплексів і регуляції експресії генів.
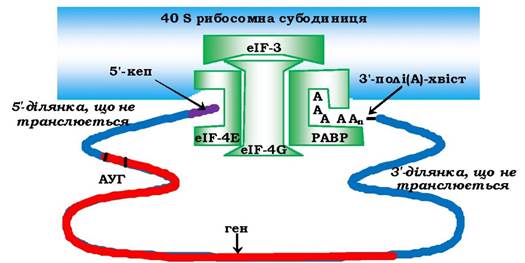
Рис. 6.40. Формування ініціаторного комплексу еукаріотів:
РАВР - полі(А)-зв'язувальний білок