БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.10.Біосинтез білка
6.10.6.Елонгація поліпептидних ланцюгів
Під час елонгації приєднання активованих амінокислот як у еукаріотів, так і в прокаріотів проходить у три послідовні етапи:
✵ розпізнавання та зв'язування аміноацил-тРНК з А-центром рибосоми;
✵ утворення пептидного зв'язку за участю пептидилтрансферазного центру рибосоми;
✵ переміщення (транслокація) рибосоми на один кодон уздовж мРНК у напрямку її З'-кінця.
Трансляційний процес має невисоку швидкість порівняно з реплікацією ДНК. Синтез білка у прокаріотів відбувається зі швидкістю приєднання приблизно 20 амінокислотних залишків за секунду, тоді як реплікон синтезує ДНК зі швидкістю близько 1000 нуклеотидів за секунду. Уповільнення процесу біосинтезу білка пов'язано з необхідністю точної постановки відповідних аміноацил-тРНК в А-центр рибосоми та з можливістю корекції цього процесу.
Елонгація у прокаріотів. На першому етапі елонгаційного циклу відбувається коректна постановка відповідної аміноацил-тРНК в А-центр рибосоми. У бактерій цей процес каталізується білковим фактором EF-Tu-мономером (молекулярна маса 47·103), що містить ГТФ-зв'язувальний центр (від англ. Elongation Factors - фактори елонгації). E. coli має 135000 молекул EF-Tu, що свідчить про його значну поширеність у клітині. Потрійний комплекс аміноацил-тРНК- EF-Tu-ГТФ (майже всі молекули аміноацил-тРНК перебувають invivo у складі таких комплексів) може вільно дифундувати до А-центру рибосоми. При коректному спарюванні в разі, якщо антикодон аміноацил-тРНК комплементарний кодону мРНК в А-центрі, комплекс ефективно взаємодіє з рибосомою. Залучення аміноацил-тРНК до рибосоми відбувається за рахунок гідролізу ГТФ до ГДФ і Фн з подальшими конформаційними змінами в комплексі EF-Tu-ГДФ і вивільненням його з рибосоми. Відновлення активного комплексу EF-Tu-ГТФ відбувається за участю білкового фактора EF-Ts(молекулярна маса 35-103) і ГТФ (рис. 6.41). Отже, аміноацил- тРНК розташовується в А-центрі рибосоми й позиціонує себе для подальшого етапу - формування пептидного зв'язку.
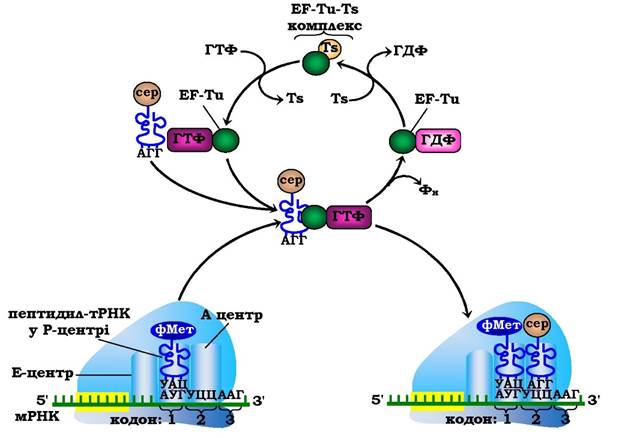
Рис. 6.41. Перший етап елонгаційного циклу в прокаріотів: розпізнавання кодону та зв'язування аміноацил-тРНК з А-центром рибосоми
Другий етап елонгаційного циклу - утворення пептидного зв'язку в результаті реакції транспептидації. Під час нуклеофільної атаки атома азоту, що входить до складу α-аміногрупи, яка є складовою частиною аміноацил-тРНК (А-центр), на вуглець карбонільного залишку в пептидил-тРНК (Р-центр) відбувається перенесення залишку формілметіоніну на NHa-групу аміноацил-тРНК і утворюється перший пептидний зв'язок у молекулі майбутнього білка (рис. 6.42; 6.43). Каталіз цієї реакції в пептидилтрансферазному центрі рибосоми проходить за участю 23S рРНК великої субодиниці, що має властивості ферментів і належить до класу рибозимів.
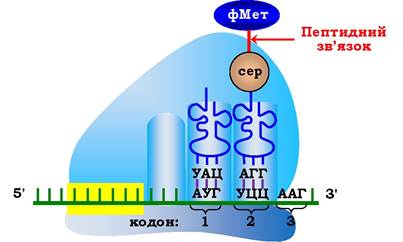
Рис. 6.42. Другий етап елонгаційного циклу у прокаріотів - утворення пептидного зв'язку
На цьому етапі відбувається формування гібридних центрів на рибосомі: антикодони залишаються відповідно в А- та Р-центрах, 3'- і 5'-кінці дипептидил-тРНК переміщуються в Р-центр рибосоми, а деаміноацильована ініціаторна тРНК розміщує свої 3'- і 5'-кінці в Е-центрі рибосоми (рис. 6.44).
На третьому етапі - транслокації, що каталізується білковим фактором EF-G (молекулярна маса 80·103), за гідролізу ним ГТФ відбувається повне переміщення (разом з антикодоном пептидил-тРНК транслокується відповідний кодон мРНК) пептидил-тРНК у Р-центр рибосоми. Це переміщення рибосоми відносно мРНК (від 5'- до 3'-кінця) строго на один триплет (кодон) нуклеотидних залишків сприяє переходу деаміноацильованої тРНК у Е-центр рибосоми з подальшим вивільненням її в цитозоль, а в А-центрі розміщується наступний кодон мРНК, котрий визначає, яка наступна амінокислота приєднається до пептиду, що зростає (рис. 6.45).
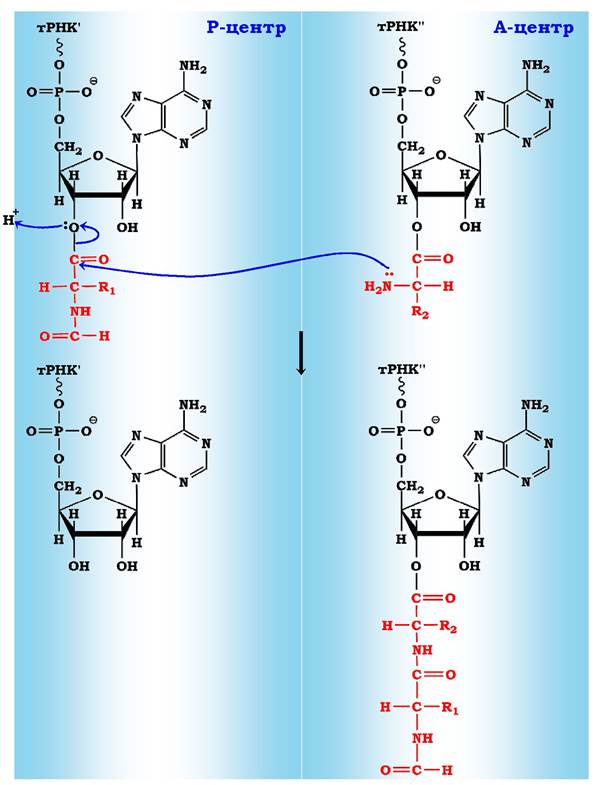
Рис. 6.43. Схема утворення пептидного зв'язку:
Р - центр містить пептидил-тРНК (І);
А - центр містить аміноацил-тРНК (II)
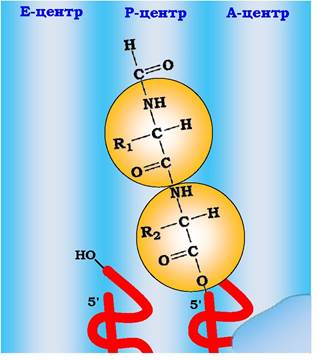
Рис. 6.44. Гібридні центри рибосоми
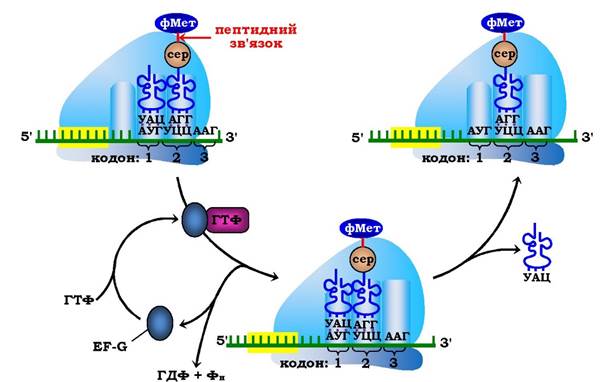
Рис. 6.45. Третій етап елонгаційного циклу у прокаріотів — транслокація
Таким чином, на стадії елонгації відбувається послідовне нарощування поліпептидного ланцюга по одному амінокислотному залишку в строгій відповідності до кодонів у молекулі мРНК.
Елонгація в еукаріотів. Процес елонгації в еукаріотів не відрізняється принципово від прокаріотичного мікроциклу, хоча й характеризується вищим рівнем організації та компартменталізації компонентів. Білкові фактори eEF-1A (молекулярна маса 50·103), eEF-2 (молекулярна маса 100·103) є функціональними аналогами EF-Tu і EF-G у прокаріотів. Регенерація eEF-1A·ГДФ до eEF-ЕА·ГТФ відбувається за участю eEF-^. Утворення пептид- ного зв'язку каталізується великою 60S субодиницею, а саме її 28S рРНК. На сьогодні відкрита група РНК із властивостями ферментів (рибозимів). Вважається, що рибозими є "реліктами" раннього періоду еволюції.
У результаті елонгації відбувається подовження пептидного ланцюга на один амінокислотний залишок. Повторення циклів за кількістю змістовних кодонів мРНК завершує весь етап елонгації.