БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.2. Структура білків
5.2.4. Супервторинна структура білків
Просторова структура кожного білка є індивідуальною й визначається його первинною структурою. Але порівняння конформацій різних за структурою та функціями білків виявило наявність у них схожих комбінацій елементів вторинної структури. Такий специфічний порядок формування вторинних структур називають супервторинною структурою білків. Ця структура формується за рахунок міжрадикальних взаємодій.
Певні характерні поєднання α-спіралей і β-структур часто позначають як "структурні мотиви». Вони мають специфічні назви "α-спіраль - поворот - α-спіраль", "структура β-діжечки", "лейцинова застібка», "цинковий палець» тощо. Специфічне просторове розміщення α-спіралей і β-структур формується за рахунок між- радикальних взаємодій.
Супервторинна структура типу β-діжечки справді нагадує діжку, де кожна β-структура (на рис. 5.16 позначена стрілкою) розміщена всередині та зв'язана з α-спіральною ділянкою полі- пептидного ланцюга, що знаходиться на поверхні молекули.
Супервторинну структуру у вигляді β-діжечки мають деякі ферменти, наприклад тріозофосфатізомераза й один домен пі- руваткінази (рис. 5.16).
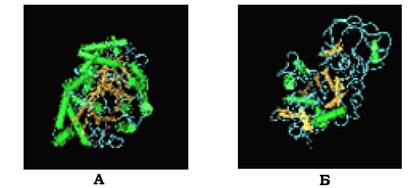
Рис. 5.16. Супервторинні структури у вигляді β-діжечки:
А - тріозофосфатізомераза, Б - домен піруваткінази
Структурний мотив α-спіраль - поворот - α-спіраль знайдений у багатьох ДНК-зв'язувальних білках. Двоспіральна структура ДНК має дві борозенки - велику й малу. Велика борозенка добре влаштована для зв'язування білків з невеликими структурними ділянками.
У даний структурний мотив входя-ть дві α-спіралі (одна коротша, інша довша), сполучені поворотом поліпептидного ланцюга. Коротша α-спіраль розміщується впоперек борозенки, а довша - у великій борозенці, утворюючи нековалентні специфічні зв'язки радикалів амінокислот із нуклеотидами ДНК (рис. 5.17).
Супервторинну структуру у вигляді "цинкового пальця" також часто знаходять у ДНК-зв'язувальних білках. "Цинковий палець» - це фрагмент білка, який містить близько 20 амінокислотних залишків, в якому атом цинку зв'язаний з радикалами чотирьох амінокислот: зазвичай із двома залишками цистеїну та двома - гістидину (рис. 5.18).
Два близько розміщені залишки цистеїну відокремлені від двох інших залишків гістидину (або цистеїну) амінокислотною послідовністю, що складається приблизно з 12 амінокислотних залишків. Ця ділянка білка утворює α-спіраль, яка може специфічно зв'язуватися з регуляторними ділянками великої борозенки ДНК. Специфічність взаємодії ДНК-зв'язувального білка з певною ділянкою ДНК залежить від послідовності амінокислотних залишків, розміщених в ділянці "цинкового пальця».
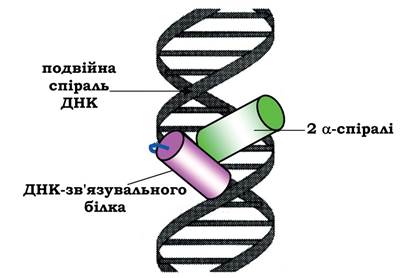
Рис. 5.17. Зв'язування супервторинної структури α-спіраль - поворот - α-спіраль ДНК-зв'язувального білка у великій борозенці ДНК
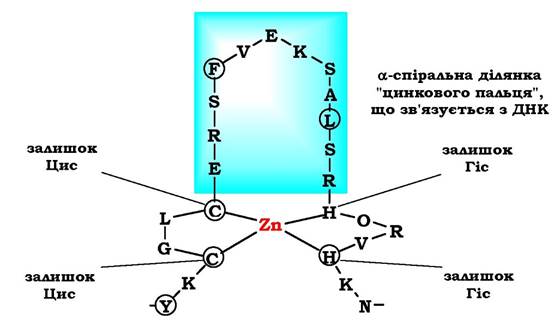
Рис. 5.18. Фрагмент ДНК-зв'язувального білка у вигляді "цинкового пальця"
Деякі ДНК-зв'язувальні білки олігомерні, тобто містять у своєму складі декілька поліпептидних ланцюгів. Крім того, існують білки, які функціонують у комплексі з іншими білками. Об'єднання протомерів або окремих білків у комплекси іноді здійснюється за допомогою структурних мотивів, які називаються "лейциновою застібкою».
На поверхні кожного з двох взаємодіючих пептидних ланцюгів або білків є α-спіральна ділянка, що містить щонайменше 4 залишки лейцину. Лейцинові залишки розміщуються через кожні 6 амінокислот один від одного. Оскільки кожен оберт α- спіралі містить 3,6 амінокислотні залишки, радикали лейцину знаходяться на поверхні кожного другого оберту.
Лейцинові залишки α-спіралі одного білка можуть взаємодіяти з лейциновими залишками другого білка за допомогою гідрофобних взаємодій, з'єднуючи їх разом (рис. 5.19).
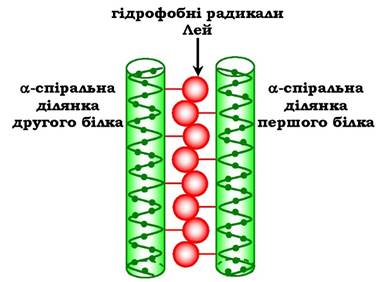
Рис. 5.19. "Лейцинова застібка" між α-спіральними ділянками двох білків
Прикладом з'єднання білків за допомогою "лейцинової застібки» можуть бути гістони - ядерні білки, до складу яких входить велика кількість позитивно заряджених амінокислот - аргініну та лізину. Молекули гістонів об'єднуються в комплекси, що складаються з восьми мономерних білків і утримуються "лейцинови- ми застібками", незважаючи на те, що всі мономери мають сильний позитивний заряд.
Доменна структура білків. Якщо поліпептидний ланцюг білка містить більше 200 амінокислот, то, як правило, її просторова структура сформована у вигляді двох чи більше доменів. Домен - ділянка поліпептидного ланцюга, яка в процесі формування просторової структури набуває незалежно від інших ділянок того самого ланцюга конформації глобулярного білка. Так, легкий ланцюг імуноглобуліну G складається з двох доменів. У деяких випадках доменами називають окремі структурні ділянки поліпептидного ланцюга.
Домени можна виділити, діючи на білок протеолітичними ферментами, котрі легко розривають пептидні зв'язки на ділянці поліпептидного ланцюга, розміщеній між доменами. Після цього деякі домени можуть зберігати свої біологічні властивості.