БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.2. Структура білків
5.2.5. Четвертинна структура білків
Багато білків містять у своєму складі тільки один поліпептид- ний ланцюг. Їх називають мономерами. До мономерів належать і білки, що складаються з кількох ланцюгів, але сполучених ковалентно, наприклад, дисульфідними зв'язками (тому інсулін потрібно розглядати як мономерний білок).
Разом із тим, існують білки, які складаються з двох і більше поліпептидних ланцюгів. Після формування тривимірної структури кожного поліпептидного ланцюга вони об'єднуються за допомогою тих самих слабких взаємодій, які брали участь в утворенні третинної структури: гідрофобних, іонних, водневих.
Кількість і взаємне розміщення поліпептидних ланцюгів у просторі називають четвертинною структурою білків. Окремі поліпептидні ланцюги у такому білку називають протомерами, або субодиницями. Білок, який має у своєму складі декілька протомерів, називають олігомерним.
До складу олігомерних білків може входити від двох до кількох десятків протомерів, хоча найчастіше зустрічаються білки, що містять від двох до чотирьох поліпептидних ланцюгів (димерні, тетрамерні білки).
Так, фермент гексокіназа містить у своєму складі 2 протомери; білок еритроцитів гемоглобін і фермент лактатдегідрогеназа - 4; фермент внутрішньої мембрани мітохондрій цитохромоксида- за - 13, а глутамінсинтетаза - 12 протомерів (рис. 5.20). Існують також великі багатофункціональні комплекси, які мають у своєму складі кілька десятків поліпептидних ланцюгів (скажімо, піруват- дегідрогеназний комплекс складається з 312 протомерів).
Деякі олігомерні білки містять ідентичні протомери (наприклад, гексокіназа), інші складаються з різних протомерів. Так, у складі гемоглобіну присутні два а- і 2 β-протомери, а в складі лактатдегідрогенази, яка має 4 протомери, 2 типи мономерів (Н і М) у різних тканинах можуть об'єднуватися у різних сполученнях (наприклад, 4Н або 3Н + 1М і т. д.).
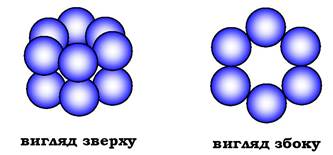
Рис. 5.20. Субодинична структура глутамінсинтетази
Олігомерні білки мають велику молекулярну масу. Білки з молекулярною масою понад 50 000 Да практично завжди містять декілька мономерних поліпептидних ланцюгів. Порівняно з індивідуальними мономерними білками олігомери виконують складніші функції.
Упізнавання й приєднання окремих протомерів олігомерного білка відбувається завдяки формуванню на їхній поверхні контактних ділянок. Останні складаються з радикалів амінокислот, зібраних у даному місці в процесі утворення третинної структури білка. Сукупність цих радикалів формує унікальні поверхні, здатні з високою специфічністю з'єднуватись одна з одною.
Специфічність зв'язування контактних ділянок визначається їхньою комплементарністю. Комплементарність - просторова та хімічна відповідність взаємодіючих поверхонь. Крім геометричної відповідності, функціональні групи радикалів амінокислот на одній контактуючій поверхні мають утворювати слабкі хімічні зв'язки з радикалами амінокислот на другій поверхні (рис. 5.21). На ділянці контактних поверхонь зазвичай міститься багато гідрофобних радикалів амінокислот, у результаті об'єднання яких формується гідрофобне ядро олігомерного білка. Гідрофільні радикали можуть утворювати водневі та іонні зв'язки.
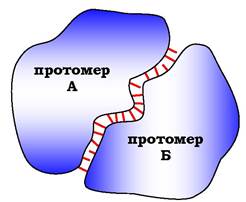
Рис. 5.21. Схема утворення димерної білкової молекули:
між протомерами А і Б утворюється велика кількість слабких зв'язків, позначених на рисунку рисочками
Отже, взаємодія протомерів здійснюється в багатьох точках контактуючих поверхонь з утворенням десятків слабких зв'язків. Завдяки цьому контактні поверхні сполучаються з високою специфічністю й помилки формування четвертинної структури білків практично повністю виключаються.
Комплементарність - універсальний принцип, властивий живій природі й лежить в основі упізнавання та сполучення не тільки протомерів, але й інших (не обов'язково білкових) молекул.