БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.4. Функціонування білків
5.4.1. Активний центр білків і вибірковість зв'язування його з лігандом
Активний центр білків - певна ділянка білкової молекули, розташована в її заглибині ("кишені"), сформована радикалами амінокислот і здатна комплементарно зв'язатися з лігандом. У лінійній послідовності поліпептидного ланцюга радикали, що формують активний центр, можуть знаходитися на значній відстані один від одного.
Висока специфічність зв'язування білка з лігандом забезпечується комплементарністю структури активного центру білка структурі ліганду (рис. 5.25).
Під комплементарністю розуміють просторову й хімічну відповідність взаємодіючих молекул. Ліганд повинен мати здатність входити та просторово збігатися з конформацією активного центру. Цей збіг може бути неповним, але завдяки конформаційній лабільності білка активний центр здатний до невеликих змін і "підганятися" під ліганд. Крім того, між функціональними групами ліганду й радикалами амінокислот, які утворюють активний центр, повинні виникати зв'язки, що утримують ліганд в активному центрі. Зв'язки між лігандом і активним центром білка можуть бути як нековалентними (іонними, водневими, гідрофобними), так і ковалентними.
Активний центр білка - відносно ізольована від навколишнього середовища ділянка білкової молекули, сформована амінокислотними залишками. У цій ділянці кожен залишок, завдяки
своєму індивідуальному розміру та функціональним групам формує "рельєф" активного центру. Об'єднання таких амінокислот у єдиний функціональний комплекс змінює реакційну здатність їхніх радикалів. Амінокислотні залишки, що входять до складу активного центру, часто називають "ансамблем" амінокислот.
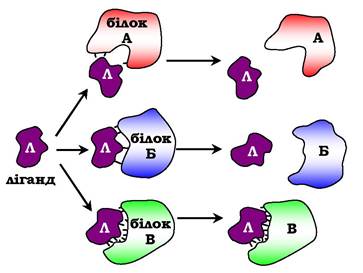
Рис. 5.25. Взаємодія білка з лігандом:
А і Б - некомплементарна взаємодія та руйнування зв'язків між білком і лігандом; В - комплементарна взаємодія білка з лігандом
Унікальні властивості активного центру залежать не тільки від хімічних властивостей формуючих його амінокислот, але й від їхньої точної взаємної орієнтації у просторі. Тому навіть незначні порушення загальної конформації білка в результаті точкових змін його первинної структури або умов навколишнього середовища можуть привести до зміни хімічних і функціональних властивостей радикалів, які формують активний центр, до порушення зв'язування білка з лігандом і його функції. Під час денатурації активний центр білків руйнується і відбувається втрата їхньої біологічної активності.
Часто активний центр формується таким чином, що доступ води до функціональних груп його радикалів обмежений, тобто створюються умови для зв'язування ліганду з радикалами амінокислот.
У деяких випадках ліганд приєднується тільки до одного з атомів, що має певну реакційну здатність, наприклад, приєднання О2 до заліза міоглобіну або гемоглобіну. Але властивість даного атома вибірково взаємодіяти з О2 визначається властивостями радикалів, що оточують атом заліза у складі гему. Гем міститься і в інших білках, таких як цитохроми. Однак функція атома заліза в цитохромах інша, він є посередником для передачі електронів від однієї речовини до іншої, при цьому залізо стає то дво-, то тривалентним.
Центр зв'язування білка з лігандом часто розміщується між доменами. Наприклад, протеолітичний фермент трипсин, що бере участь у гідролізі пептидних зв'язків харчових білків у кишечнику, має два домени, розділених борозенкою. Внутрішня поверхня борозенки формується амінокислотними радикалами цих доменів, розташованими в поліпептидному ланцюзі далеко один від одного (Сер177, Гіс40, Асп85).
Різні домени в білку можуть переміщуватись один відносно одного під час взаємодії з лігандом, що полегшує подальше функціонування білка. Як приклад можна розглянути роботу гексокінази, ферменту, що каталізує перенесення фосфорного залишку з АТР на молекулу глюкози (під час її фосфорилювання). Активний центр гексокінази розміщується в щілині між двома доменами (рис. 5.26). Під час зв'язування гексокінази з глюкозою домени, які її оточують, зближуються, і субстрат опиняється в "пастці", що полегшує його подальше фосфорилювання.
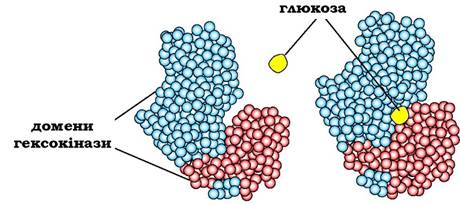
Рис. 5.26. Зв'язування гексокінази з глюкозою
Основна властивість білків, яка лежить в основі їхніх функцій, - вибірковість приєднання до певних ділянок білкової молекули специфічних лігандів. Вони можуть бути неорганічними (часто іони металів) і органічними речовинами, низькомолекулярними та високомолекулярними сполуками. Існують ліганди, які змінюють свою хімічну структуру під час приєднання до активного центру білка (зміни субстрату в активному центрі ферменту). Є ліганди, які приєднуються до білка тільки в момент функціонування (наприклад, О2, що транспортується гемоглобіном), і ліганди, котрі постійно зв'язані з білком і виконують допоміжну роль під час функціонування білків (наприклад, залізо, що входить до складу гемоглобіну).
У тих випадках, коли амінокислотні залишки, які формують активний центр, не можуть забезпечити функціонування даного білка, до певних ділянок активного центра можуть приєднуватися небілкові молекули. Так, в активному центрі багатьох ферментів присутній іон металу (кофактор) або органічна небілкова молекула (кофермент). Небілкову частину, міцно зв'язану з активним центром білка і необхідною для його функціонування, називають простетичною групою. Міоглобін, гемоглобін і цитохроми мають в активному центрі простетичну групу - гем, який містить залізо.
Сполучення протомерів в олігомерному білку - приклад взаємодії високомолекулярних лігандів. Кожен протомер, сполучений з іншими протомерами, слугує для них лігандом, як і вони для нього.
Іноді приєднання якого-небудь ліганду змінює конформацію білка, у результаті формується центр зв'язування з іншими лігандами. Наприклад, білок кальмодулін після зв'язування з чотирма іонами Са2+ у специфічних ділянках набуває здатності взаємодіяти з деякими ферментами, змінюючи їхню активність.
Швидкість взаємодії білка з лігандом визначається концентраціями білка й ліганду в розчині, а також ступенем комплементарності білка й ліганду.
Константа дисоціації - характеристика спорідненості активного центра до ліганду. Оскільки взаємодія білка з лігандом - оборотний процес, то його можна описати наступним рівнянням: ![]()
де Р - білок, L - ліганд, PL - комплекс білка з лігандом, К1 - константа швидкості зв'язування білка з лігандом, К-1 - константа швидкості розпаду комплексу PL.
Коли швидкості утворення й розпаду комплексу однакові, йдеться про те, шо система знаходиться у стані рівноваги:
![]()
Звідси
![]()
Співвідношення констант розпаду [PL] комплексу і його утворення називається константою дисоціації (Кдис) комплексу [PL]. Чим менша Кдис, тим більше молекул ліганду зв'язано з білком, тим більша комплементарність між P та L і тим більша спорідненість ліганду до білка, тобто між Кдис і спорідненістю ліганду до білка є обернено пропорційний зв'язок.
Іноді при описуванні процесу зв'язування білка з лігандом використовують величину, обернену Кдис, яка називається константою зв'язування (Кзв), або асоціації:
![]()
Між Кзв і спорідненістю ліганду до білка є прямо пропорційна залежність. За постійної концентрації білка збільшення концентрації ліганду приводить до росту концентрації [PL]. Ця залежність носить характер гіперболічної кривої (рис. 5.27). Крива прямує до максимуму, коли за деякої концентрації ліганду всі молекули білка перебувають у зв'язаному з лігандом стані (відбувається насичення білка лігандом). Ступінь насичення білка лігандом можна виразити рівнянням:![]()
(де Ро - концентрація білка до додавання ліганду).
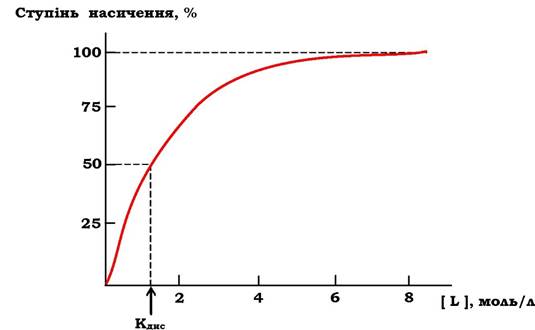
Рис. 5.27. Графік насичення білка лігандом
При напівнасиченні білка лігандом концентрації [PL] і [P] є рівними, і з рівняння Кдис, наведеного вище, випливає, що Кдис = [L], тобто Кдис чисельно дорівнює концентрації ліганду, за якої 50 % білка знаходиться в комплексі з лігандом. Тому за кривою насичення можна знайти Кдис і оцінити спорідненість даного білка до ліганду.
Як було описано вище, при зростаючій концентрації ліганду насичення білка обмежується його концентрацією. У разі надлишку ліганду всі молекули білка містяться у складі комплексу [PL]. Але якщо збільшувати концентрацію білка, то кількість [PL] почне збільшуватися пропорційно кількості білка. Концентрацію комплексу [PL] можна реєструвати за допомогою вимірювання поглинання світла. Ураховуючи, що його кількість пропорційна концентрації білка, можна на основі побудованого графіка визначати концентрацію білка в розчині (рис. 5.28).
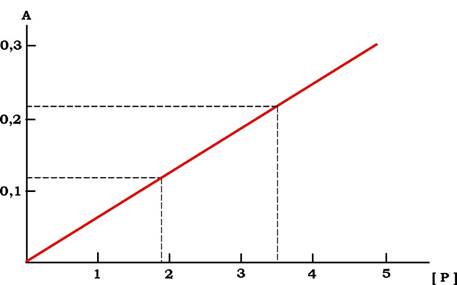
Рис. 5.28. Графік залежності зміни поглинання світла, що відображає концентрацію комплексу [PL] від концентрації білка Р:
на осі А реєструють зміну, наприклад, поглинання світла, викликане утворенням комплексу [PL]