БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.5. Особливості функціонування олігомерних білків
5.5.1. Структура й функції міоглобіну
Міоглобін відносять до класу гемвмісних білків, тобто він містить простетичну групу (гем), досить міцно зв'язану з білковою частиною. Міоглобін належить до глобулярних білків; він має тільки один поліпептидний ланцюг.
Міоглобін є в червоних м'язах і бере участь в акумулюванні кисню. Під час інтенсивної м'язової праці, коли парціальний тиск кисню в тканині падає, О2 вивільнюється з комплексу з міоглобіном і використовується в мітохондріях клітин для отримання необхідної для роботи м'язів енергії. Міоглобін містить не- білкову частину (гем) і білкову (апоміоглобін).
Гем - молекула, яка має структуру циклічного тетрапіролу, де чотири пірольні кільця сполучені метиленовими містками і містять чотири метильні, два вінільні та два пропіонатні бічні ланцюги. Ця органічна частина гему називається протопорфірином. Можливі 15 варіантів розташування бокових ланцюгів, але у складі гемопротеїнів присутній лише один ізомер - протопорфірин ІХ. У гемі чотири атоми азоту пірольних кілець поєднані чотирма координаційними зв'язками з Fe2+, який міститься в центрі молекули (рис. 5.29).
Апоміоглобін - білкова частина міоглобіну; первинна структура представлена послідовністю з 153 амінокислот, які у вторинній структурі укладені у вісім а-спіралей. α-Спіралі позначають латинськими літерами від А до Н, починаючи з N-кінця поліпептидного ланцюга; вони містять від 7 до 23 амінокислот. Для позначення індивідуальних амінокислот у первинній структурі апоміоглобіну використовують або написання їхнього порядкового номера від N-кінця (скажімо, Гіс64, Фен138), або букву а-спіралі й порядковий номер даної амінокислоти в цій спіралі, починаючи з N-кінця (наприклад, Гіс F8).
Третинна структура має вигляд компактної глобули (усередині практично немає вільного місця), утвореної за рахунок петель і поворотів в ділянці неспіралізованих ланцюгів білка. Внутрішня частина молекули практично повністю складається з гідрофобних радикалів, за винятком двох залишків Гіс, які розміщуються в активному центрі.
Гем - специфічний ліганд апоміоглобіну, що приєднується до білкової частини в заглибині між двома α-спіралями - F і Е. Центр зв'язування з гемом утворений переважно гідрофобними залишками амінокислот, що оточують гідрофобні пірольні кільця гему.
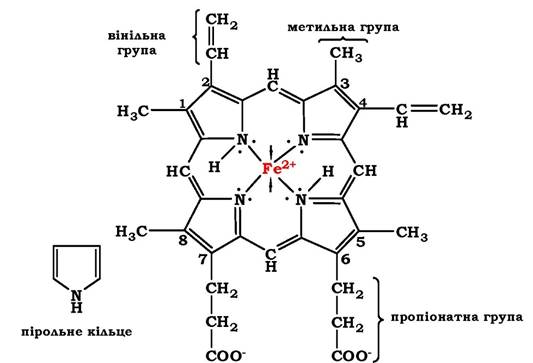
Рис. 5.29. Будова гему, який входить до складу міоглобіну та гемоглобіну
До активного центру апоміоглобіну крім гідрофобних амінокислот входять також два залишки Гіс (Гіс64 і Гіс93, або Гіс Е7 і Гіс F8), які відіграють важливу роль у функціонуванні білка. Вони розміщені по різні боки від площини гему і входять до складу спіралей F і Е, між якими розміщується гем. Атом заліза в гемі може утворювати шість координаційних зв'язків, чотири з яких утримують Fe2+ у складі протопорфірину ІХ (сполучаючи його з атомами азоту пірольних кілець), а п'ятий зв'язок виникає між Fe2+ і атомом азоту імідазольного кільця Гіс F8 (рис. 5.30).
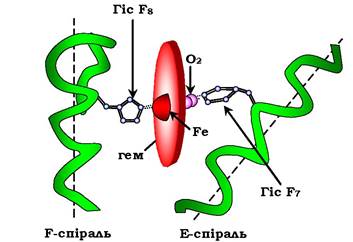
Рис. 5.30. Розміщення гему в активному центрі апоміоглобіну та протомерів апоміоглобіну
Гіс Е7 хоч і не зв'язаний з гемом, він, однак, необхідний для правильної орієнтації та приєднання другого ліганду - О2 до міоглобіну.
Амінокислотне оточення гему створює умови для досить міцного, але оборотного зв'язування О2 з Fe2+ міоглобіну. Гідрофобні залишки амінокислот, які оточують гем, запобігають проникненню до центра зв'язування міоглобіну води й окисненню Fе2+ до Fe3+. Тривалентне залізо у складі гему не здатне приєднувати О2.